10月12日,瓦里安(NYSE: VAR)宣布,已获得美国食品药品监督管理局(FDA)批准的首个FLASH治疗临床试验的研究性器械豁免(Investigational Device Exemption, IDE),将以实验性治疗模式进行超高剂量率放射治疗。
这项名为FAST-01(治疗骨转移癌的FLASH放射疗法可行性研究)的可行性研究预计将招募10例骨转移癌患者,评估临床工作流程可行性、治疗相关副作用,以及通过测量受试者的疼痛缓解程度来评估治疗效果。预计2020年底前将招募到首例患者。
FLASH治疗采用超高剂量率,通常在小于1秒的时间内完成治疗,可比常规放射治疗快100倍以上。FAST-01研究将使用瓦里安ProBeam®粒子加速器进行研究性应用,调整后为癌症患者提供这一先进的非侵入性治疗选择。
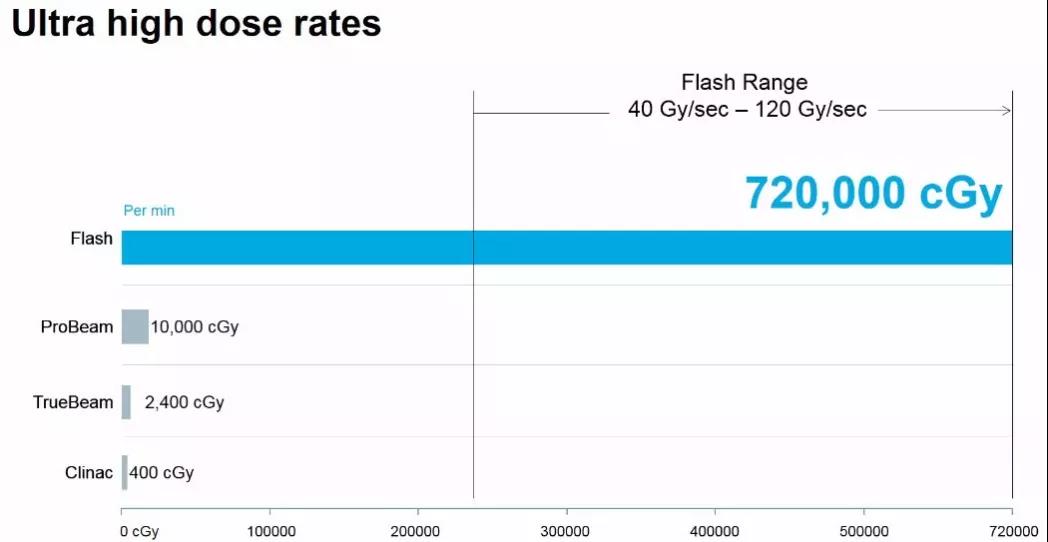
Flash治疗与常规光子和质子治疗剂量率对比
多年来,研究者一直在研究超高剂量率放射治疗这一概念。瓦里安的潜心研究引领进入到临床研究阶段,致力于投资实验室和临床前研究,并支持 FlashForward™联盟,该联盟由来自世界各地的20名领先的机构成员组成,其中包括放射肿瘤学、转化科学和医学物理学领域的专家。
“FLASH治疗可能是近数十年来癌症治疗领域最重要的进展之一。”瓦里安首席发展官兼质子治疗解决方案总裁Kolleen Kennedy说道,“我们在ProBeam平台上推进FLASH治疗的成果,证明了瓦里安在改善癌症患者治疗研究上的投入,也证明了FlashForward™联盟与世界各地临床医生合作的重要性。”
“FLASH治疗的临床前研究表明,使用超高剂量率将可能降低整体毒性,更好地保护周边健康组织。”瓦里安高级副总裁兼首席医疗官Deepak Khuntia 博士补充说,“该研究是一项重要的概念验证,尤其对于深部肿瘤而不仅是浅表肿瘤,它提供了更多的必要数据,帮助我们加深对 FLASH 疗法原理的了解。”