TLX591-CDx在美国商标为Illumet,是一款68Ga-PSMA-11冷却套件,用于开发放射性药物产品和诊断剂。Telix的前列腺癌计划包括一个伴随诊断成像剂(TLX591-CDx)和一种治疗剂(TLX-591),以改善前列腺癌的检测和治疗。
该冷却套件可在室温下快速制备68Ga-PSMA-11,并已在美国和欧洲出售以供研究使用。它旨在使前列腺癌的诊断更加容易,因为它创建了一种“摇一拍”的诊断药物,可以准确显示出癌症如何在患者体内传播。
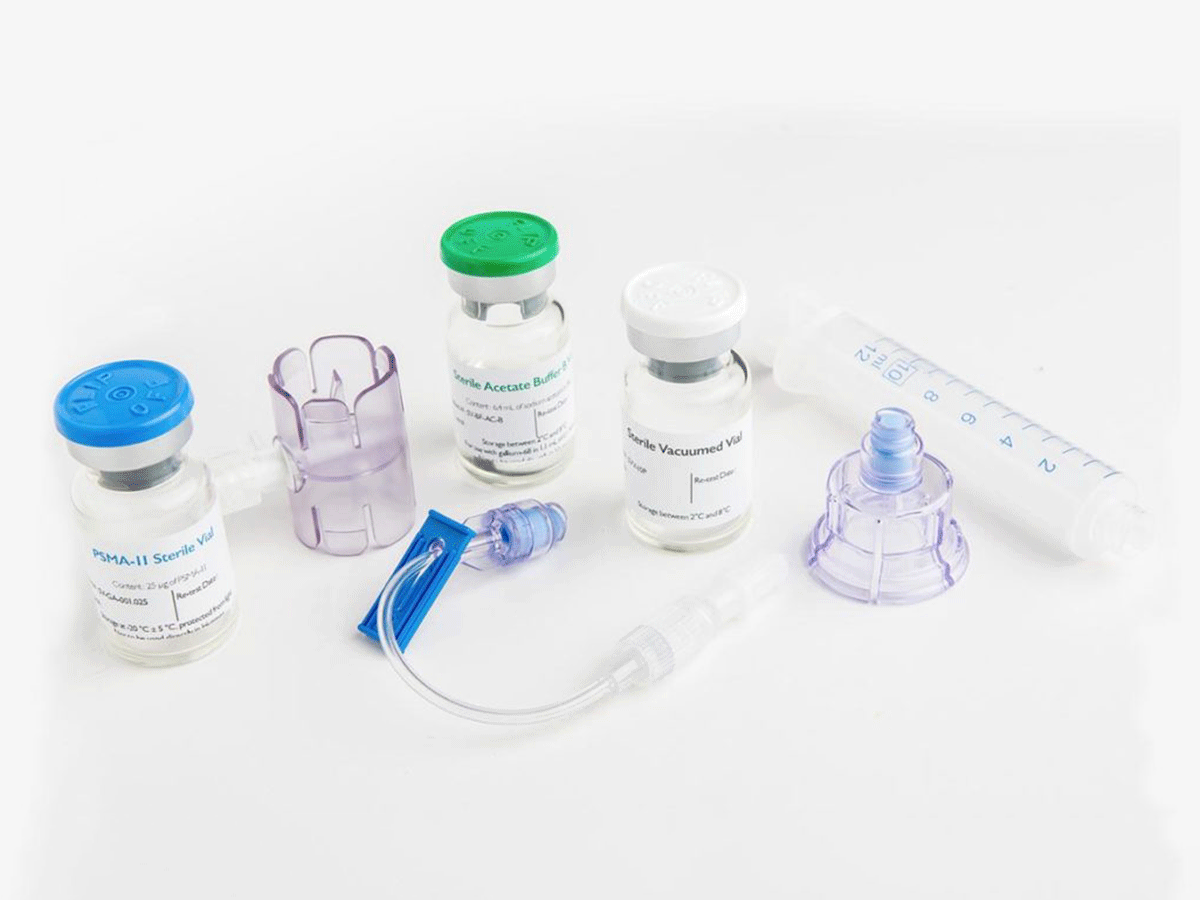
PET扫描仪使用少量放射性,对患者进行成像以检测靶标的表达程度,然后将放射性同位素附着到靶向分子上,该靶向分子以高度的特异性和选择性将辐射传递给癌细胞。
“当我们治疗患者,我们知道他或她会如何应对,因为我们知道自己的目标是访问”的Telix首席执行官Christian贝伦布鲁赫告诉BioWorld。
他说:“向美国食品药品监督管理局(FDA)申请我们的第一个产品是国家药品监督管理局(NDA)的主要商业转折点,并且是在今年早些时候我们向欧洲提交药物申请之后进行的。”在前列腺癌管理中具有广泛的诊断用途。”
根据505(b)在提交包(2)途径包括该在的Telix首席商务官戴维·卡德纪念斯隆-凯特琳癌症中心在纽约,进行讲了一个420-患者的疗效研究BioWorld。该研究达到了其主要共同目标,旨在确定影像学上前列腺癌相对于“真相”的位置。
安全研究中还有200例患者,这些数据来自Novartis Endocyte III VISION试验,该试验是一种177Lu前列腺特异性膜抗原(PSMA)-617靶向剂。
“当诺华开始进行III期临床试验时,FDA告诉诺华,它需要一种成像产品来将患者纳入该试验中,” Cade说,“诺华和Endocyte没有成像剂,但Telix提供了将其成像剂转让给诺华,以换取用于监管目的的数据。
他说:“我们提供的安全性数据是前瞻性收集的,来自诺华VISION试验的安全性数据。”他指出,前列腺疗法抗体TLX-591即将进入名为PROSTACT的III期注册试验。
FDA支持Telix用TLX591-CDx(68Ga-PSMA-11)成像定义PSMA表达的提议,作为选择III期PROSTACT试验患者的基础。该试验的患者选择将通过使用TLX591-CDx伴随诊断成像来丰富,以鉴定患有PSMA表达的前列腺癌患者。
Telix首席医学官科林·海沃德(Colin Hayward)表示:“镓PSMA成像是前列腺癌成像的重要进展,包括在进行高危干预之前对高风险男性的成像。
在这种患者情况下,新数据支持68Ga-PSMA-11成像优于传统成像,还清楚地表明68Ga-PSMA-11成像可改善临床和治疗决策。潜在地在我们的NDA中包含其他分析的机会是值得的,最终可能使我们能够将我们的产品提供给大量需要治疗的患者。”
TLX-591与比利时高级核医学成分(ANMI)SA共同开发。Behrenbruch说,与拜耳公司的Xofigo(镭Ra 223二氯化物)相比,TLX-591在某些前列腺癌患者中显示了近35个月的生存期收益,Behrenbruch说。
2018年12月,Telix以810万澳元的价格收购了ANMI,以加速Illumet在美国和欧洲的商业化。Behrenbruch说,此次收购使Telix得以加快其在美国用于该试剂盒的保密协议,并且由于对前列腺癌技术的需求不断增加,这也是一种防御措施。
前列腺癌是全球第四大常见癌症,2018年,有130万男性被诊断出患有前列腺癌。
Telix在2019年7月宣布,它筹集了4,000万澳元(2,740万美元),这将使其前列腺癌和肾癌成像产品通过后期临床试验,并将在2020年之前提供足够的跑道来支持这些产品在欧洲的商业推出,美国和澳大利亚。
Telix的管道包括可用于诊断和治疗的放射治疗药物,本质上具有放射学和化学疗法的特征并将其合并。


![拜耳氯化镭[223Ra]注射液中国获批用于前列腺癌治疗](https://www.ccnta.cn/uploadfile/2020/0903/20200903091221792.png)


