纳米技术在提高难溶性药物生物利用度、实现药物的可控及靶向性释放、整合不同的治疗模式于同一平台等方面具有独特优势。但是在实际应用中却面临着包括血液循环、跨血管转运、畸形的肿瘤血管、致密的肿瘤细胞外基质等在内的多种生物学障碍,导致纳米粒子主要分布于肿瘤组织外围,难以深入肿瘤内部发挥杀伤作用。
近期,中国科学院苏州生物医学工程技术研究所研究员董文飞团队等开发了一种由近红外光触发的粒径-电荷双转换纳米组装体,用于乳腺癌的光控化疗与免疫联合治疗。
在该项研究中,研究人员组装出一种新型纳米载药体。该纳米组装体以装载化学治疗药物多柔比星(DOX)的二硒键桥连的生物可降解型介孔硅粒子(MONs)为内核,以装载有光治疗药物吲哚菁绿(ICG)的温敏聚合物N-异丙基丙烯酰胺作为外壳。负电性的温敏外壳可以阻止DOX的提前泄漏、延长纳米制剂的血液循环时间;在808nm近红外光作用下,ICG所产生的光热效果将促使温敏外壳发生相变而脱落,实现纳米粒表面电荷由负到正的反转。同时,ICG所产生的活性氧(ROS)可以通过打断二硒键促进内核MONs迅速降解从而产生含有DOX的小粒子(115nm到20nm)。
这种光驱动电荷-粒径双转换的纳米组装体能够携带药物深入肿瘤内部并扩散于整个组织,发挥光控化疗效果,并增强肿瘤免疫原性。在动物体内实验中发现,与免疫检查点抑制剂anti-PD-1联合使用后,不仅可以增强对原位肿瘤的杀伤效果,同时能有效抑制乳腺癌细胞向远端肺部组织的转移,延长小鼠的生存期,具有良好的生物安全性。
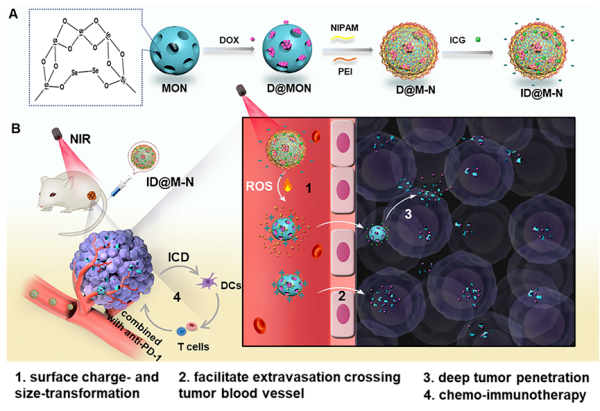
图2 纳米组装体用于乳腺癌的近红外光响应-化学-免疫治疗示意图