前文介绍了PET/CT放疗定位在头颈部肿瘤中的应用,本期我们来看下PET/CT如何助力食管癌精准放疗。由于食管癌早期无明显特征,大多数患者确诊后往往已处于中晚期。放疗联合同步化疗是临床治疗食管癌的常用方式,尤其是对于不可手术的局部晚期食管癌或局限于区域淋巴结转移的病变。
PET/CT在食管癌精准放疗中发挥着重要作用,包括食管癌原发肿瘤和累及区域淋巴结的精确勾画,以及对治疗反应和预后的有效评估等。武汉大学中南医院核医学科和肿瘤放化疗科联合,针对头颈部肿瘤、食管癌、肺癌和宫颈癌等率先在湖北省内开展了三维适形和三维调强放射治疗技术的研究。
下述病例为食管非角化型鳞状细胞癌术后1月余,患者为求进一步诊治,于中南医院核医学科Biograph mCT设备上行18F-FDG PET/CT放疗定位扫描。
PET/CT图像显示左侧锁骨上区、右肺门、降主动脉右前方、T8椎体前方、右侧第6后肋旁多发肿大淋巴结,代谢异常增高,考虑转移性病变。

患者有放化疗指征,无明显放化疗禁忌,肿瘤放化疗科依据PET/CT放疗定位图像精准勾画靶区后行纵隔放疗(Dt=50.4Gy/28F) ,同时行两周期DF方案同步化疗(氟尿嘧啶+顺铂)。

放疗术后两月行18F-FDG PET/CT复查,复查图像显示全身未见明显FDG代谢异常增高,肿瘤糖酵解总量(TLG)由157.30降为0,提示完全代谢缓解。
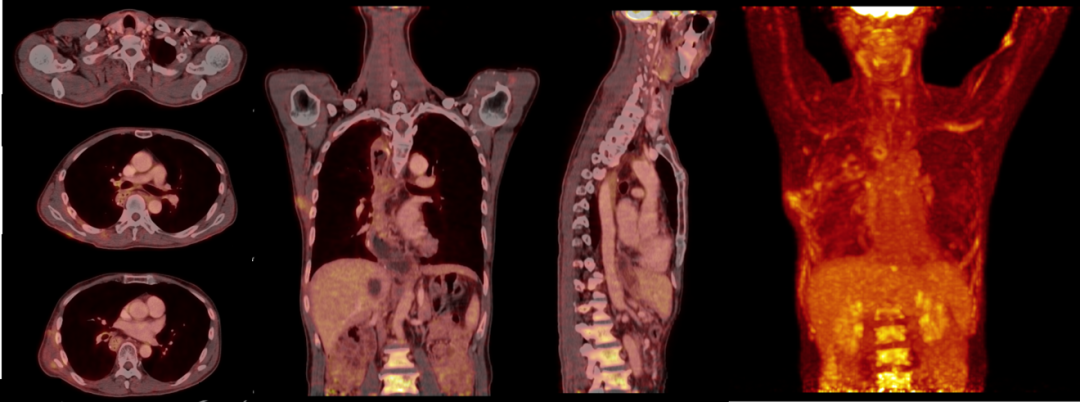
感谢武汉大学中南医院提供病例
PET/CT在食管癌精准放疗中发挥着重要作用,包括食管癌原发肿瘤和累及区域淋巴结的精确勾画,以及对治疗反应和预后的有效评估等。临床上一般会基于CT增强定位图像并参考PET/CT定位图像,或基于CT增强与PET/CT的配准图像进行靶区勾画。将PET/CT应用于放疗定位中,是为了综合考量食管癌患者原发病灶、区域淋巴结受累和远处转移情况,以精确勾画靶区。
单纯使用CT的形态学特征进行食管癌靶区的勾画存在一定误差,因CT无法准确地区分肿瘤与炎症组织,以及与食管壁有密切关联的肿大淋巴结等,而且食管在解剖上毗邻心脏、肺等,放疗过程中会对正常心脏组织造成一定的损伤,且影响患者肺功能,导致放射性肺炎、放射性气管炎等并发症。
将PET/CT应用于食管癌放疗定位中,依据代谢影像与解剖影像的融合,可以提高靶区勾画的准确性并优化治疗计划,最大可能给予靶区高剂量的同时给予危及器官低剂量,同时有效降低不同医师间靶区勾画的差异,以此来提升治疗效果,减少并发症[1]。
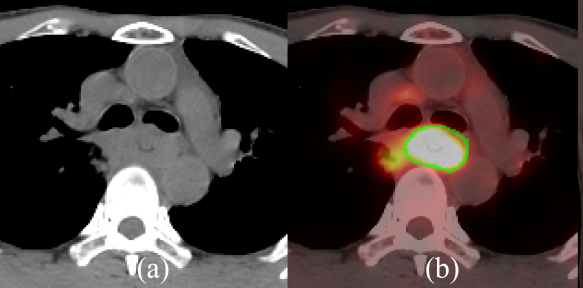
与CT相比,PET/CT可更为准确地勾画食管癌原发肿瘤灶(绿线为真实肿瘤边界)[2]
食管癌靶区勾画中另一个重要的内容是确定淋巴结转移范围。食管癌具有高淋巴结转移率,其转移模式难以预测。当前CT诊断标准是按照受累淋巴结直径范围来判断淋巴结是否出现转移,但是仅依据形态学特征进行转移淋巴结的诊断存在一定的误差。
18F-FDG PET/CT能够有效提高转移淋巴结诊断的准确性,其转移淋巴结探测的敏感性达74.7%,特异性达97.2,准确性达92%,均优于单独CT[3]。将PET/CT应用于食管癌放疗定位中,对于区域淋巴结照射体积及范围的精确确定,减少转移淋巴结的漏照十分关键。
术前新辅助放化疗(nCRT)是局部晚期食管癌患者的首选治疗方法。术前放化疗通过阻断血行和淋巴结转移来改善预后,同时也缩小了原发肿瘤的大小以提高手术切除率[4]。研究发现nCRT后达到病理学完全缓解(PCR)的患者,无论是否接受后续的手术切除,预后均相对较好;而在nCRT中无反应的患者即使接受完全的手术切除,预后也可能很差[5]。
因此,准确评估食管癌患者nCRT后的治疗反应具有重要的临床价值,对于病理学完全缓解的患者,可以避免不必要的手术切除,而对于治疗中无反应的患者,则可能减少不必要的放化疗副作用,指导后续治疗策略的制定。
传统的CT和内镜超声等形态学检查无法准确地从放疗导致的瘢痕、水肿和纤维组织中将残留的肿瘤组织鉴别出来,PET/CT等功能学影像则能够更为全面地反映肿瘤的的生物学特征,在形态学变化之前提供肿瘤代谢活性变化的信息[6]。2021年Xu的一项最新研究显示18F-FDG PET/CT有助于食管癌患者nCRT后的再分期,并与DW-MRI结合,可更为准确地评估食管癌原发肿瘤对于nCRT的病理反应[7]。
该项研究回顾了51例病理确诊的局部晚期食管鳞癌患者,在nCRT前和nCRT后4-6周分别进行了两次18F-FDG PET/CT全身扫描,以两次PET/CT扫描各项代谢参数的变化与手术切除术后病理标本进行对照,以探究PET/CT在食管癌nCRT治疗反应评估中的价值。
该研究显示在原发肿瘤病理完全缓解(pCR-T)组和non-pCR-T组之间,nCRT后PET/CT检查得到的SUVmax、MTV、TLG参数有显著性差异,并且前后两次PET/CT检查SUVmax和MTV参数的变化也有显著性差异。
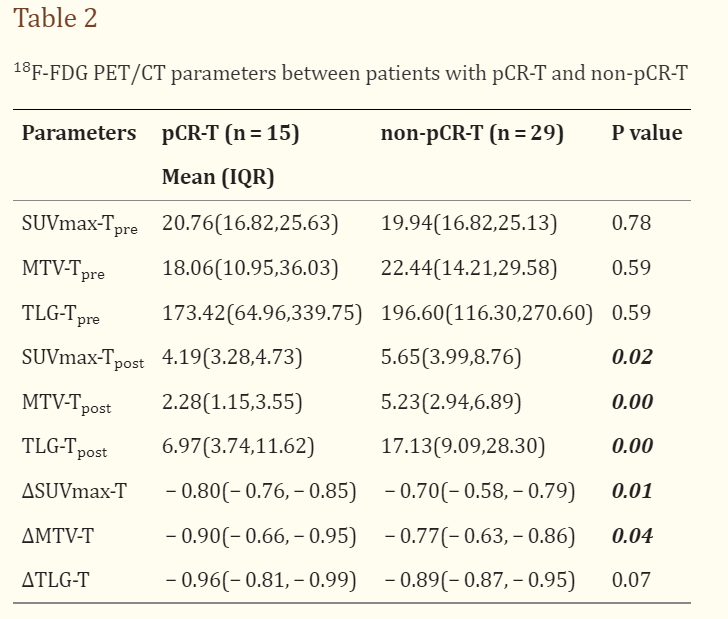
通过ROC分析将PET/CT检查得到的各项代谢参数用于预测食管癌原发肿瘤nCRT后的治疗反应,显示nCRT后PET/CT检查得到的TLG具有最好的预测价值(AUC=0.828),并且将TLG参数与DW-MRI扫描获取的表观扩散系数(ADC)结合,可以提高食管癌nCRT疗效评估的准确性(AUC=0.914),TLG与ADC结合预测食管癌nCRT病理反应的敏感性和特异性分别为90%和86.36%。

此外,2019年Kim的一项研究显示食管癌患者放化疗术后18F-FDG PET/CT显示的早期代谢反应可以准确预测患者的复发和预后[8]。该研究回顾了21例病理确诊的食管癌患者,在放化疗术前(within 30d)和术后(9-12d)分别进行了18F-FDG PET/CT全身显像,并对所有患者进行了平均为期13.1个月的随访(1.6-23.6月),通过两次PET/CT扫描获取的代谢参数评估其在食管癌放化疗术后复发及预后中的价值。
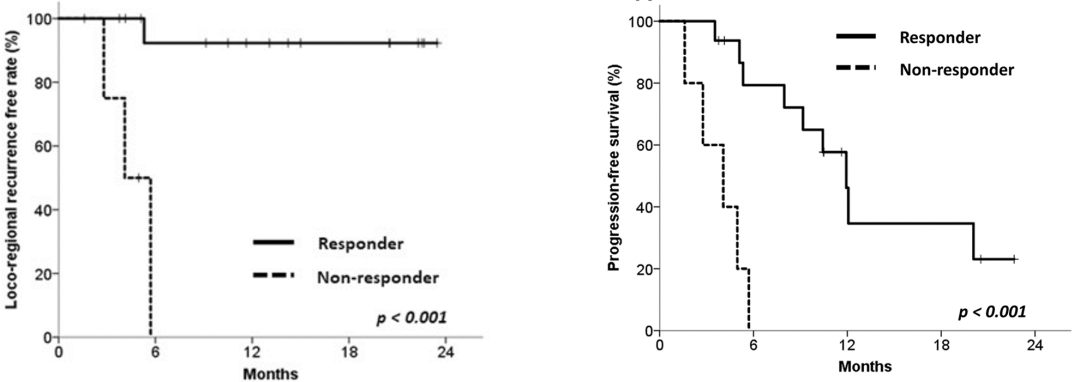
研究显示两次PET/CT扫描间MTV的变化与食管癌放化疗术后局部复发密切相关(p=0.03),而SUVmean的变化与远端转移密切相关(p=0.02)。以1.14 (MTV PET2/MTV PET1)作为阈值来判断食管癌放化疗术后是否为病理完全反应,可以看到治疗反应组和无反应组的1年无局部复发率(Loco-regional recurrence free rate)有显著性差异(92.3 vs 0%),并且,治疗反应组显示出更长的无进展生存期(Progression-free survival)和更高的1年无进展生存率(34.6 vs 0%)。
精准的放疗定位和疗效评估离不开先进的技术和设备。西门子医疗和业界知名的放疗设备司瓦里安医疗强强联合,为临床从诊断到治疗到随访,提供诊治一体化精准放疗最完整的解决方案。
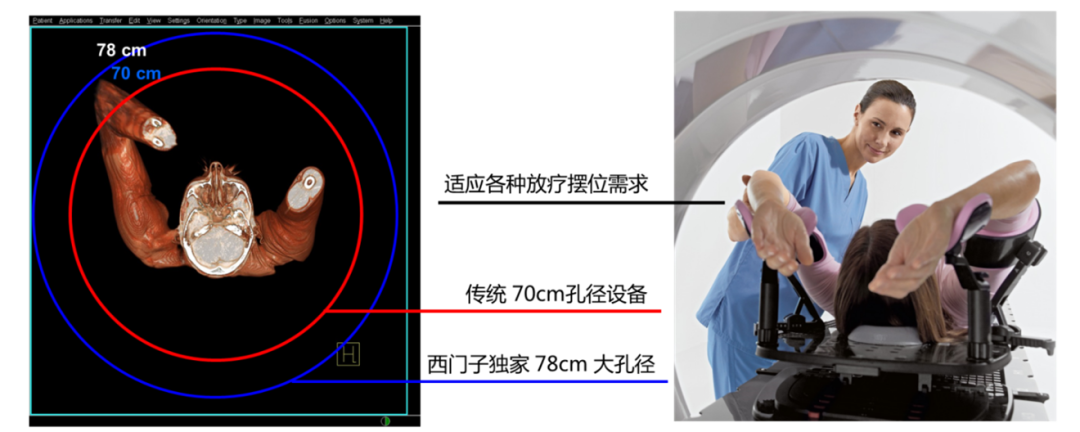
业界独家78cm大孔径
西门子采用业界独家的78cm大孔径PET/CT,相比于传统70cm孔径,78cm大孔径短机身一体化的设计,提升了约25%的孔径内空间。25%的孔径内空间提升一方面可以满足更大体型,特别是肥胖人群的日常扫描需求,提高了患者检查的舒适度;另一方面,更大的有效视野和摆位空间也满足了放疗定位时的多种摆位要求。
西门子PET/CT不仅仅是PET系统的大孔径,更是PET与CT一体化的78cm大孔径,这使得该设备还可作为单独的CT模拟机使用,一次患者扫描获得PET/CT与CT增强定位图像,极大地减少了两组图像间患者的体位误差,靶区勾画结果更为准确。
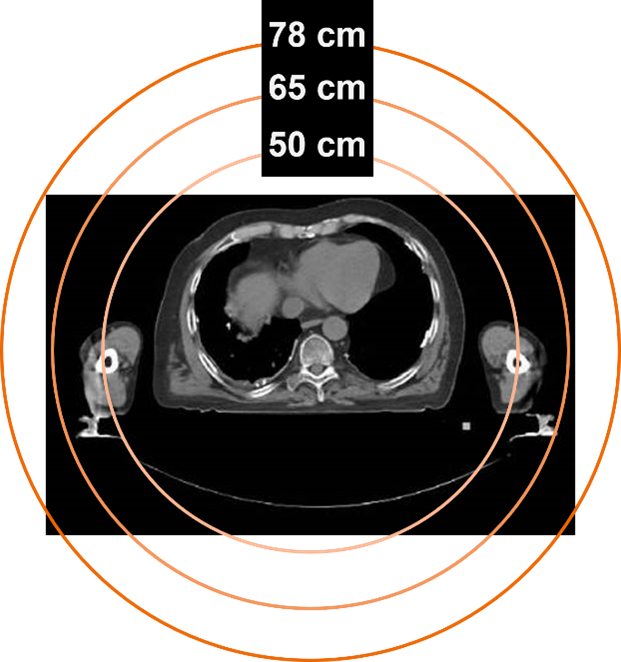
78cm HD高清视野(FOV)
基于独家的78cm大孔径,西门子推出了78cm HD高清视野(FOV)重建技术,与传统的50cm CT重建视野相比,实现了全CT视野可见,能完全覆盖所有人群的全部身体部位,同时完全兼容各种外展位、大体积放疗支架等。
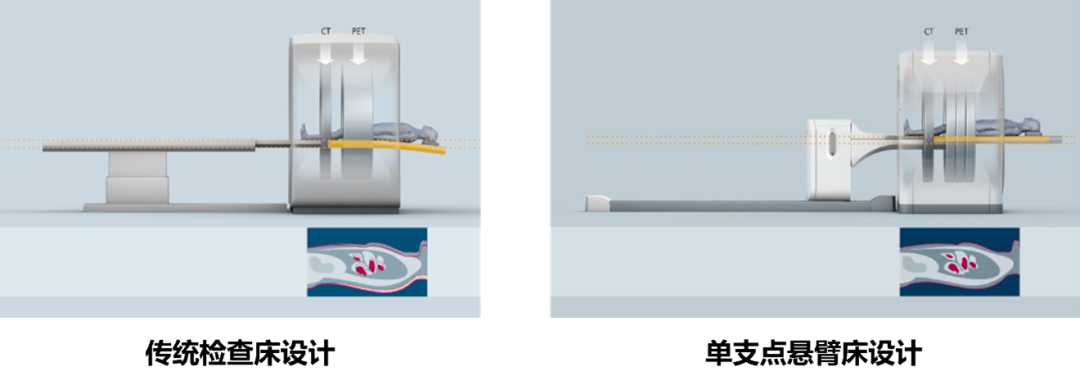
西门子采用磁悬浮驱动、单支点悬臂式检查床,保证了PET与CT扫描时检查床保持等力臂移动,消除了常规检查床使用床板延伸式时所导致的移动偏差,实现了PET图像与CT图像的精确配准。此外,西门子磁悬浮单支点检查床是业界唯一符合TG66标准的检查床,同时可提供原厂专业放疗定位床板,保证了最精准的放疗定位精度。
独家ALPHA人工智能引擎
在放疗疗效评估过程中,为观察病灶的变化,需要医师进行多个时间点图像的比较,因此需要图像之间的同轴配准。传统的配准方法是逐像素进行的,然而当两次检查的视野、患者姿势(如:手臂举起VS手臂放下)或检查床设置(如:厚床垫VS薄床垫)发生变化时,传统算法会失效,错误的配准可能导致病灶消失的假象。
西门子ALPHA人工智能引擎基于专利的器官识别技术进行解剖学配准,使医师更便捷的对比不同检查的数据。该技术在每幅图像中探测多达28个解剖学标识,基于解剖一致性检查进行过滤,并利用重叠标识对不同时间点的图像进行配准。由于ALPHA配准是以解剖结构识别为基础的,就像人工进行图像配准一样,而不是低水平的像素匹配,不受前述所有变化的影响,实现了不同时间点PET/CT图像的精确配准。

ALPHA配准可对多时间点的检查图像进行匹配,即使它们有不同的FOV
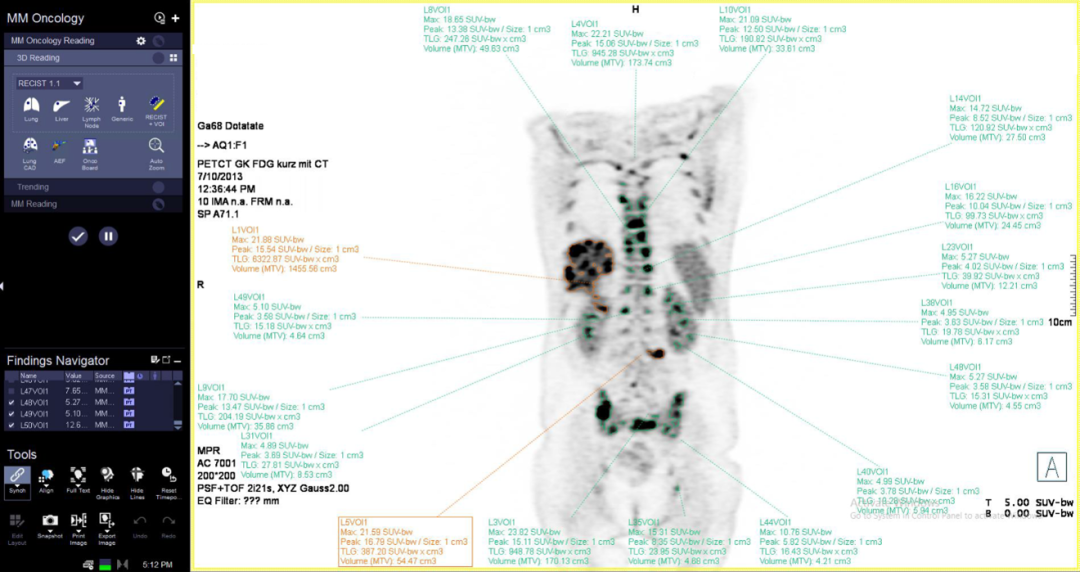
MFS多病灶分割
准确的疗效评估源自规范化的测量方法。根据指南,对同一患者进行PERCIST标准评估,需测量全身所有病灶并选出代谢最高的5个病灶进行计算。此外,对于肝脏或主动脉区域的参考值测量也有相应的规定。
西门子推出的MFS(Multi-Foci Segmentation)多病灶分割软件能够根据PERCIST标准的要求自动标记肝脏或者主动脉区域的参考VOI,自动识别、分割全身病灶VOI并筛选出用于评估疗效的5个病灶,根据这些病灶的多种定量指标(SUV、MTV、TLG)自动计算结果,给出疗效评估等级(完全代谢缓解、部分代谢缓解、疾病稳定、疾病代谢进展)。
使用MFS多病灶分割可减少操作者的主观依赖性,提高临床工作效率,并提供精准、客观的疗效评估及预后评价所需参数,为临床工作及科研提供高效、准确的解决方案。
SUV作为一种半定量参数,在不同设备或不同重建参数下存在较大差异,可达-54%~+86%,而根据实体瘤疗效评价标准(Percist),对于疗效评估的SUV偏差阈值是需要控制在±30%以内。多个时间点图像中SUV的较大差异限制了Percist标准的应用,使得疗效评估结果准确性无法得到保证,而准确的放疗疗效评估对肿瘤患者的后续治疗方案选择及随访监测方案至关重要。