
该项研究中,研究小组提出了一个新的实验平台,它是第一个通过紧凑、可调谐的有源等离子透镜束流线,以0.2 Hz的重复频率向生物样品递送2 MeV能量的拍瓦激光驱动质子脉冲。在107 Gy/s的超高瞬时剂量率下,在临床相关的7 ~ 35 Gy的质子剂量下照射生长在10 mm直径场上的细胞单层膜。暴露于LD质子的人类正常细胞和肿瘤细胞的剂量依赖性细胞存活率测量显示,在总剂量为7 Gy或更高总剂量的情况下,正常细胞的细胞存活率显著高于肿瘤细胞,而在临床剂量率的X射线参考照射中,没有观察到相同程度的细胞存活。这些发现提供了初步证据,表明紧凑型LD质子源为研究FLASH效应背后的物理、化学和生物学机制提供了一个新的、有前景的平台。
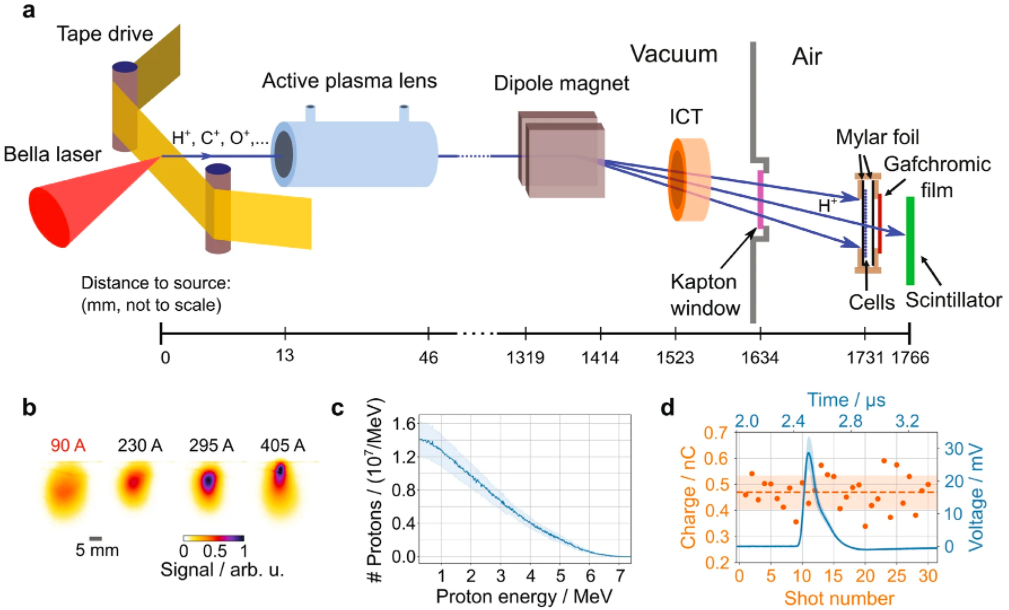
图. 高重复率、超高瞬时剂量率、激光驱动质子束线。(a) BELLA拍瓦激光器上的激光驱动质子束示意图。(b) 四种不同的放电电流应用于有源等离子体透镜,用闪烁体屏幕在电池样品位置测量的质子束二维空间分布,所有细胞辐照均在90 A下进行。(c) 源自束流递送模拟的应用于细胞的质子光谱。平均质子能量为2.4 MeV。阴影区域代表镜头间波动的标准偏差。(d) 通过积分电流互感器(ICT)在0.2 Hz下连续30次发射的在线离子束电荷测量(橙色标记)。橙色虚线代表平均电荷,蓝色曲线代表平均ICT电压信号,阴影区域对应标准偏差。
研究团队的第一项研究刚刚取得成功,研究已深入第二阶段。BELLA研究团队目前正在开发新的瞄准技术,将激光聚焦到更高的强度,进而产生更高能量的质子。现有的聚焦系统产生的束流仅足以将FLASH放射治疗递送到在非常薄的薄片中培养的细胞。当这种称为iP2的升级完成时,更高能量的离子束将足够强大,可以更深入地穿透活组织。Snijders和该论文的共同作者、资深科学家Jian-Hua Mao随后将评估束流在动物模型上的安全性和治疗效果,首先在表面组织,其次在内部肿瘤上。

Kei Nakamura、Antoine Snijders和Lieselotte Obst-Huebl(从左至右)在BELLA激光设施中,在质子束路径中校准含有人体细胞的墨盒。该装置可以测量激光驱动质子的生物效应。
伯克利生物系统与工程(BSE)部门的癌症研究员、高级科学家、共同主要作者Antoine Snijders说:“质子治疗中心设施大型且昂贵,因此其在世界范围内的应用受到限制。目前,全球范围内质子治疗中心地理分布及患者获得质子治疗的机会有限。获得更广泛应用、降低成本的方法是降低设施的成本和占地面积,意味着我们需要更紧凑的离子源用于质子加速器。”
伯克利实验室加速器技术与应用物理部门主任Cameron Geddes表示:“激光驱动的加速器在比传统系统小得多的空间提供加速,并产生短而强的脉冲,除了用于研究基础物理外,还为医学和其他应用创造了新的机会。”
伯克利实验室加速器技术和应用物理部门、BELLA中心的研究科学家Lieselotte Obst-Huebl表示:“激光驱动的质子加速器的工作原理是将高能激光对准一个薄箔,从而产生一个很小的等离子体区域,在这个区域中,原子在真空室中剥离出电子。在等离子体中,强电场在几微米的距离内加速质子和离子(人类头发的宽度为几十微米)。”
BELLA中心负责实验的副主任Kei Nakamura表示:“在质子治疗中心能够购买紧凑型激光加速器来为质子治疗提供能量之前,这项技术还有很长的路要走。它仍处于起步阶段,但正在迅速发展。BELLA中心最初只是用于开发电子加速器,而建造质子加速器的工作到2015年才开始。伯克利实验室和BELLA中心的该项合作项目始于2018年,我们很高兴有这样的合作。”