安进(AMGEN)近日公布了1/2期CodeBreaK 100研究中靶向抗癌药Lumakras(sotorasib)治疗KRAS G12C突变晚期胰腺癌患者的疗效和安全性数据。数据显示,Lumakras显示出令人鼓舞且具有临床意义的抗肿瘤活性,并具有积极的获益-风险特征。
这些数据来自38例先前接受过多种方案治疗(heavily pre-treated,过度预治疗)的晚期胰腺癌患者,近80%患者接受Lumakras作为三线或多线治疗。结果显示,经中心确认的客观缓解率(ORR)为21%、疾病控制率(DCR)为84%。38例患者中,有8例经盲法独立中心审查(BICR)实现部分缓解(PR)。8例PR患者中有2例仍处于缓解。截至数据截止(2021年11月1日),中位随访16.8个月,中位缓解持续时间(DOR)为5.7个月,中位无进展生存期(PFS)为4个月,中位总生存期(OS)接近7个月。该研究中没有发现新的安全信号。任何级别的治疗相关不良事件(TRAE)发生在16例(42%)患者中,腹泻(5%)和疲劳(5%)是最常见的3级TRAE。没有发生致命或导致治疗中断的TRAE。
胰腺癌是一种高度致命的恶性肿瘤。它是美国男性和女性癌症相关死亡的第四大原因,5年生存率约为10%。一线治疗后进展的晚期胰腺癌患者存在着很高的未满足医疗需求,美国FDA批准的二线疗法,提供的总生存期约为6个月,总缓解率(ORR)为16%。在一线和二线化疗进展后,还没有一种疗法显示出生存益处。尽管在治疗方面取得了进展,但在改善胰腺癌的诊断和治疗方面几乎没有进展。
据估计,大约90%的胰腺癌患者携带KRAS突变,其中KRAS G12C约占这些突变的1-2%。杜克大学医学院副教授、胃肠道肿瘤学家John Strickler表示:“经过几十年的研究,目前对胰腺癌患者的治疗提供的生存益处有限,说明迫切需要新的、安全和有效的治疗方案。在评估KRASG12C抑制剂对过度预治疗晚期胰腺癌的疗效和安全性的最大数据集中,Lumakras获得了21%的中心确认的缓解率和84%的疾病控制率。这对患者具有临床意义,因为这些患者一旦进入三线治疗,没有一种既定的标准疗法。”
Lumakras是一种KRASG12C抑制剂,于2021年5月获得美国FDA批准,用于治疗先前已接受过至少一种系统疗法、经FDA批准的检测方法证实存在KRAS G12C突变、局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
值得一提的是,Lumakras是经过近40年研究后批准的第一个KRAS靶向疗法,是第一个也是唯一一个被批准用于治疗携带KRAS G12C突变的局部晚期或转移性NSCLC患者的靶向疗法。全球每年新诊断220万肺癌病例,NSCLC约占84%。KRAS突变约占NSCLC突变的25%;其中,KRAS G12C是NSCLC中最常见的驱动突变之一,现在成为了一种“可成药”的靶点。在美国,约13%的非鳞状NSCLC患者携带KRAS G12C突变。
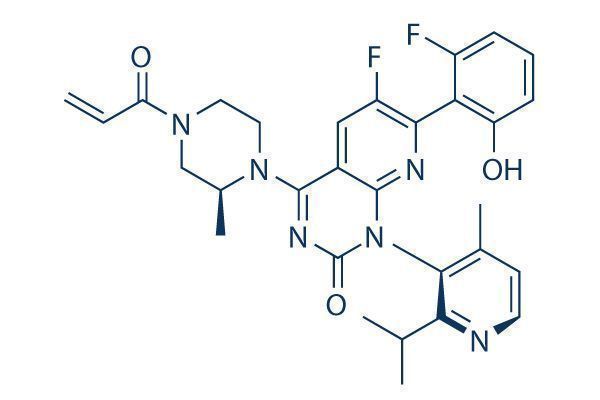
Lumakras的活性药物成分为sotorasib,这是第一个进入临床开发的KRAS G12C抑制剂。2020年12月初,美国FDA授予了sotorasib突破性药物资格(BTD)和实时肿瘤学审查资格(RTOR)。2021年1月底,sotorasib获得了中国国家药品监督管理局(NMPA)药品审评中心(CDE)授予突破性治疗药物资格。这是安进首次在中国提交“突破性治疗药物”认证申请,同时也是与百济神州达成战略合作以来的首个“突破性治疗药物”认证申请。
KRAS是被发现的首批癌基因中的一种,其突变存在于大约1/4的人类肿瘤中,是肿瘤学药物研发领域最明确的靶标之一。然而遗憾的是,尽管前景很好,但KRAS长期以来几乎无法攻克,这是由于该蛋白是一种无特征、近乎球形的结构,无明显的结合位点,很难合成一种能靶向结合并抑制期活性的化合物。这也使得KRAS成为了肿瘤药研发领域“不可成药”靶标的代名词。
sotorasib(AMG 510)是成功靶向KRAS并进入人体临床开发的首批小分子抑制剂之一,可靶向抑制携带G12C突变的KRAS蛋白。sotorasib通过将G12C突变KRAS蛋白锁定在一种非激活GDP结合状态来特异性地和不可逆地抑制其促增殖活性。
通过开发sotorasib,安进承接了过去40年来癌症研究中最严峻的挑战之一。sotorasib是第一个进入临床的KRASG12C抑制剂,目前正在进行一项最广泛的临床项目CodeBreaK,在全球五大洲探索10多种药物组合。迄今为止,全球已有4000多例患者通过临床开发项目或商业应用接受了Lumakras(欧洲商品名Lumykras)治疗。