日前,国际离子治疗联合会(PTCOG)胸部和胃肠道分委会发布食管癌质子治疗临床和技术指南。指南中,研究人员介绍了质子治疗的剂量学优势、临床效果和患者选择,同时对治疗计划和临床治疗技术进行了详述,并总结了食管癌质子治疗的未来方向。原文发表于杂志Frontiers in Oncology。质子中国将临床效果、患者选择、未来方向和结论整理后与大家分享,点击“阅读原文”或联系质子中国小编(微信号:ProntonCN)获取全文。

临床效果
新辅助和根治性放疗
过去十年已发表的描述PBT临床结果的文献有所扩展,包括了食管癌患者获得临床意义益处的前瞻性和回顾性证据。
一项回顾性研究汇总了三个机构的数据,比较了食管切除术前新辅助3DCRT、IMRT或PBT与同步化疗的结果,显示新辅助PBT与较低的肺部和伤口愈合并发症发生率相关。与XRT队列相比,PBT组的住院时间显著缩短,这可能是术后并发症减少的结果。虽然3DCRT组急性心脏事件较多,但PBT和IMRT之间无差异。最近的一项研究分析了使用IMRT或PBT治疗的479例食管癌患者的心血管事件,中位随访时间为76个月,其中18%的患者发生了3级以上的主要心血管事件。心血管事件发生在CRT后的中位时间为7个月,其中大部分(81%)发生在完成CRT后的前2年内。与3级以上事件风险增加相关的最强因素是先前存在心血管疾病和IMRT的使用(与PBT相比)。在已有心脏病的患者中,与IMRT相比,使用PBT与2年显著降低的事件发生率相关(11% vs. 30%;p=0.0018)。此外,在一项对125例接受CRT的食管癌患者进行的前瞻性注册研究中,通过比较CRT期间的FACT-E(癌症治疗功能评价量表-食管量表),接受了PBS-PT(相较于IMRT)的患者更好地保障了与健康相关的生活质量。
与XRT相比,理论上PBT将辐射剂量传递到较小体积的总血量中,并且由于循环淋巴细胞的高度放射敏感性,这种差异可能具有临床意义。例如,Shiraishi及其同事对480名食管癌患者进行的倾向匹配分析表明,与PBT相比,接受IMRT的患者中4级淋巴细胞减少症的发生率明显更高(40.4% vs. 17.6%;p<0.0001)。Mayo Clinic的研究人员最近提出了类似的发现,表明PBT与减少严重的淋巴细胞减少症存在密切关联。
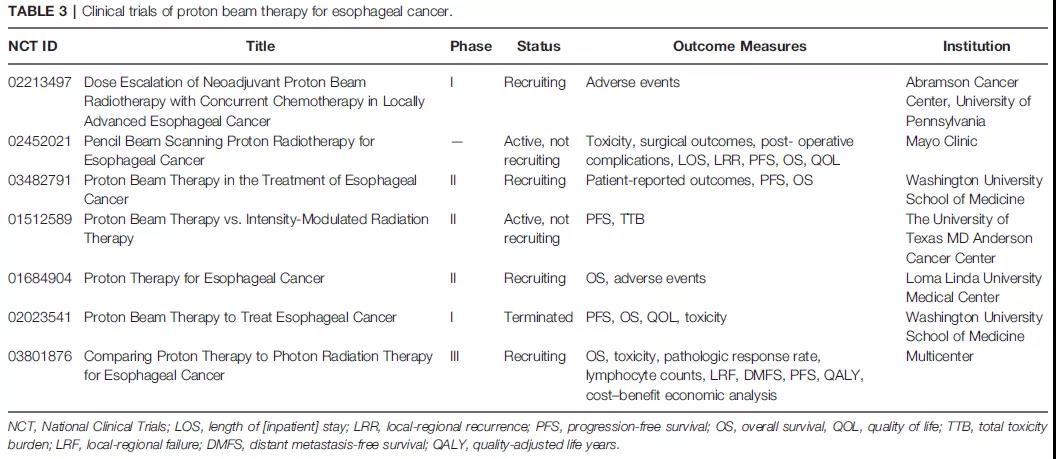
最近,MD安德森癌症中心的研究人员公布了一项比较PBT(80%PS-PBT,20%IMPT)和IMRT的2期随机试验结果。该研究的共同主要终点是无进展生存期(PFS)和一个称为总毒性负担(TTB)的新终点,是从CRT开始到1年的不同级别的11种不同毒性的综合指数。尽管该研究在107例患者中提前结束,但它显示PBT的总体TTB评分显著优化了2.5倍,术后并发症的TTB降低了7.6倍,而PFS或OS无差异。这是第一个在所有疾病部位进行的质子与光子的随机试验,且主要终点有利于质子治疗。NRG-GI006(NCT03801876)是一项比较PBT和IMRT治疗食管癌的3期随机对照试验,目前正在招募患者。该研究假设PBT的剂量学优势将转化为有意义的临床益处。而其他前瞻性临床试验也正在进行中,如表3所示。
再照射
对于此前胸部接受过放射治疗的情况下发生的复发或新发食管癌患者,可以考虑再照射,尽管可能有很大风险发生严重晚期不良反应。PBT有望大幅降低关键OAR的累积剂量,包括脊髓、心脏、肺、近端支气管树和肝脏。几项队列研究已经证明了对食管癌进行PBT再照射的可行性和令人鼓舞的早期临床结果(表4)。最近,DeCesaris等人报告了在四个机构接受PBT再照射的37例患者的回顾性队列的结果,中位再照射剂量为50.4 Gy,中位累积剂量为104 Gy,大多数患者(90%)接受了同步化疗。再照射后的中位随访时间为20个月,18个月的OS为56%,18个月的局部控制率为69%。24%的患者出现3级晚期毒性,包括需要扩张的狭窄,而一些患者出现4~5级晚期毒性(19%)。
患者选择
颈段食管、胸段食管(上、中、下)和胃食管交界处癌患者可考虑接受PBT。PBT有望在术前、根治性或术后使用时为患者提供临床获益。
强烈推荐
在以下情况下应最强烈地考虑PBT:
以根治为目的进行治疗,与以姑息治疗为目的的患者相比,预期可以更好减轻晚期毒性。
与XRT相比,由于PBT对心脏和肺的保护效果更好,患有严重的内科并发症,尤其是心脏和/或肺部并发症的患者。
虽然所有年龄段的患者都可能受益于PBT与XRT相比较低的显著晚期毒性风险,老年患者通常面临更高的治疗相关风险、死亡率和术后并发症,因而可能特别受益于PBT优越的OAR保护。
对食管癌局部和/或区域复发的患者,或新诊断的食管癌出现在先前照射过的区域,应强烈考虑PBT而不是IMRT,特别是根治性治疗。美国放射治疗协会 (ASTRO)的PBT模型政策认为再照射(累积临界结构剂量将超过耐受剂量)是“第1组适应证”,其中PBT被认为是“医学上必要的”。应谨慎评估复合剂量,以降低严重毒性的风险,包括瘘管和咯血,以及5级事件。
当使用剂量递增时应考虑PBT,因为它可以降低对关键OAR的更高毒性风险。
谨慎使用
PBT可能是合理的,但在以下情况下应谨慎使用:
胃贲门/胃体的广泛肿瘤受累(肿瘤延伸到胃食管交界处远端>5 cm)可能导致肿瘤位置的潜在的相当大的分次内和分次间差异,从而导致潜在的靶区漏照。
应减轻胃充盈(空气与液体)和呼吸运动引起的相互作用的变化,尤其是在使用IMPT时。
由于担心设备的中子剂量和后续设备故障的风险,对装有起搏器的患者使用PBT被认为是相对禁忌证,特别是对于那些依赖起搏器的患者。然而,这些患者可以在有明确定义的计划情况下进行安全的治疗,同时监测设备功能正常并在治疗过程中能应对潜在的设备功能障碍。这样的计划需要与心脏病学同行密切合作,并且如果可能的话,优先使用IMPT(相对于PS-PBT),因为前者中子剂量更低。
未来方向
随着人们越来越意识到免疫系统在癌症相关结果中发挥着不可或缺的作用,应将注意力集中在减轻辐射对免疫系统相关的影响上,尤其是对辐射敏感的淋巴细胞的影响,即使是对低至<1 Gy的剂量也是如此。与光子放疗相比,高级别淋巴细胞减少症与食管癌患者的长期预后较差有关,使用PBT可显著减少该症状。未来应考虑发展与淋巴细胞减少相关的心脏、肺、主要血管结构、骨髓和脾脏的危险器官剂量限制,并将这些限制纳入常规治疗计划优化。如果免疫检查点抑制剂成为局部食管癌的标准给药方式,减轻RT相关的严重淋巴细胞减少症的重要性以及PBT的益处可能会变得更大。
尽管基于光子的剂量递增研究对食管癌是负面的,但可以在PBT提供的减少OAR剂量的情况下重新探索这一概念。由于用于食管癌的标准剂量会导致局部失败率次优,因此采用质子治疗可能会更安全地允许剂量增加,来更好地保护邻近的关键结构受到不必要的照射,并控制由此产生的与治疗相关的不良影响和死亡率,并有可能在不增加毒性的情况下改善肿瘤控制。这对于未经手术接受根治性放射治疗的患者尤其重要。
PBT在肿瘤和OAR中的生物学效应尚不十分清楚,值得进一步研究。与光子束相比,质子束具有稍高的放射生物学有效性(RBE);因此,吸收剂量通常使用1.1的修正系数。然而,人们认识到RBE在深度剂量曲线上是变动的,即在布拉格峰区域的LET较高,尤其是在布拉格峰的远端较高。正因为如此,出于对增加的生物剂量的担心,PBT治疗计划通常避免射束射程进入关键结构。这种计划设计方法可能对将PBT用于食管癌产生影响,特别是对于PBS技术,因为后者利用后前方向的射束,射程可能延伸到包括心脏、胃和肠在内的关键结构,目前尚不清楚其临床效果。正在开发复杂的计划技术,使人们能够可视化高LET的位置,这样可以在计划过程和计划优化中考虑,这有可能进一步降低毒性并通过基于LET的计划改善肿瘤控制(图2)。
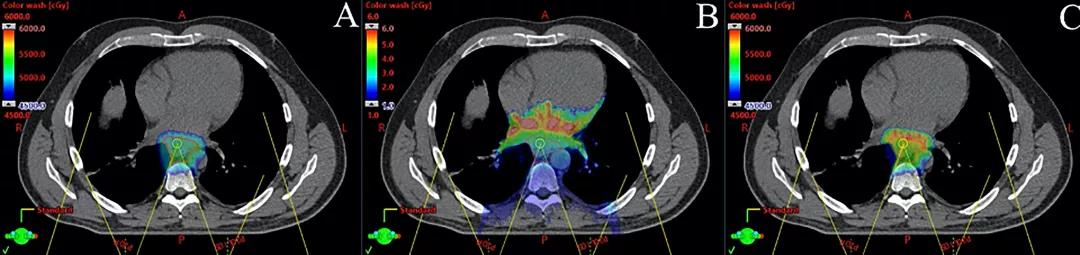
最后,由于相互作用效应,尤其是与IMPT的相互作用,会显著降低胸部计划的剂量分布质量,因此患者特定QA或类似的方法应常规考虑此类效应。对于IMPT,可以通过模拟与时间相关的束斑剂量递送和呼吸运动之间的时间关系,来完成此类QA。预计商业治疗计划系统将在未来提供相互作用效应评估。
结论
基于回顾性和随机前瞻性数据,应重点考虑将PBT用于三联疗法和非手术胸部食管癌患者,这些数据表明,与XRT相比,PBT降低了具有临床意义的毒性。鲁棒的PBT计划制定和治疗实施对于确保适当的靶区和周围OAR剂量测定至关重要。进行中的NRG-GI006 3期随机试验(NCT03801876)正在评估PBT与XRT的长期毒性和疗效结果,我们鼓励患者加入该项研究。(质子中国 编辑报道)