靶向放射疗法开发商Molecular Targeting Technologies(简称MTTI),总部位于美国宾夕法尼亚州,致力于开发针对罕见癌症的靶向放射治疗和诊断方法,目前处于临床阶段。MTTI已经获得美国国立卫生研究院(NIH)的全球独家许可,可以商业化其Evans blue(EB)平台技术专利涵盖的选定靶向放射性药物。
放射性药物也称核药,是指含有放射性同位素(核素),供医学诊断和治疗用的一类特殊药物。根据medraysintell数据,2019年全球核药市场规模约60亿美元,其中诊断药物占据主要市场,但随着越来越多的治疗性药物上市,将推动2030年全球核药市场规模达到300亿美元左右。
MTTI拥有什么样的技术平台和靶向放射性药物,能从核药市场分一杯羹?本文将对此进行介绍。
01 深耕生物制药领域,团队经验丰富
作为MTTI的首席执行官兼董事会主席,Chris Pak博士在生物制药行业拥有三十年经验,他曾在生物制药公司Centocor(现在已被医疗健康企业强生收购)任职,开发了新型放射性药物,并参与了12项针对癌症和心血管疾病的新药临床试验(IND)申请。此外,他发表了80多篇文章,拥有多项治疗和诊断方面的专利。Chris Pak博士获得了诸多奖项,比如2019年安永大费城地区年度企业家、亚洲商会杰出亚裔美国人商业奖、本富兰克林新兴商业奖、纽约州立大学校友荣誉榜和2014年中美核医学及分子影像学会(CASNMMI)终身成就奖。
同为董事会成员的Ji Li博士除了在MTTI担任首席运营官,还是生物技术公司UFOVAX的总裁、首席执行官和联合创始人。他曾担任法国特种化学品公司Rhodia亚太区研发副总裁,并在之后成为了并购、技术开发和制药事业部的董事总经理。他也是风险投资公司Comway Capital的负责人之一,并担任多家生物技术初创公司的董事。
MTTI的科学顾问团队由从事多年生物制药工作的专家组成,包括纪念斯隆凯特琳癌症中心核医学服务的临床主任、新加坡中央医院的高级顾问医师、东北大学布韦药学与健康科学学院药物靶向与分析中心主任、亚琛工业大学亥姆霍兹应用工程中心实验分子成像研究所负责人。
02 聚焦罕见癌症,研发新型技术平台
MTTI拥有一个基于Evans blue (一种偶氮染料,具有与血浆白蛋白高度亲和)的新型靶向肽放射治疗平台EvaTheraTM,用于表达生长抑素受体2型(SSTR2)和αvβ3整合素的肿瘤治疗。
EvaTheraTM技术平台对白蛋白具有很强的亲和力,能够延长靶向放射性药物的血液半衰期,并在降低血液清除率,提高吸收率的同时减少毒性。
EvaTheraTM技术平台目前拥有两款正在研发的产品:用于治疗神经内分泌肿瘤(NET)的EBTATETM(177Lu-DOTA-EB-TATE)和用于治疗胶质母细胞瘤(GBM)和非小细胞肺癌(NSCLC)的EBRGDTM(177Lu-DOTA-EBRGD)。这两款产品都已获得美国国立卫生研究院(NIH)的全球独家专利商业化许可。
EBTATE™(177Lu-DOTA-EB-TATE)
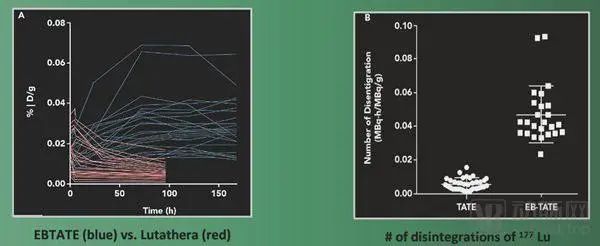
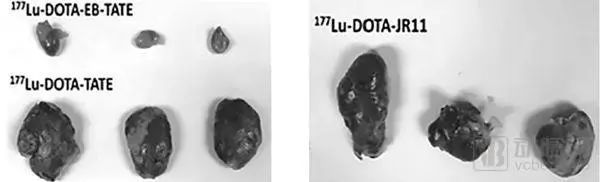
EBTATETM是一种基于EvaTheraTM治疗诊断平台的长效生长抑素类似物,由靶向奥曲酸肽、用于改善生物分布的Evans blue和携带放射性核素177Lu的螯合剂组成。 EBTATETM(177Lu-DOTA-EB-TATE)靶向SSTR2的肿瘤,而神经内分泌肿瘤(NET)高表达生长抑素受体(尤其是SSTR2)。目前MTTI已经获得FDA的新药临床试验(IND)申请,能够针对其主导产品EBTATETM(177Lu-DOTA-EB-TATE)在神经内分泌肿瘤(NET)患者中的安全性和剂量学进行I期临床研究。 177Lu标记的生长抑素类似物奥曲肽(177Lu-DOTA-TATE)是目前临床上应用最多的放射性药物。然而,177Lu-DOTA-TATE可通过肾脏快速地从血液中清除,在肿瘤病灶内滞留不良。与177Lu-DOTA-TATE相比,177Lu-DOTA-EB-TATE利用Evans blue结构能可逆性地结合血浆中的白蛋白,有效延长其在血液中的半衰期,以增加放射性药物在肿瘤内的靶向聚集和滞留。 MTTI针对晚期神经内分泌肿瘤患者的一项前瞻性试点实验表明,EBTATETM的肿瘤吸收和治疗效果均显着高于对比疗法。 在3个月内,单次低剂量(19.5mCi)的EBTATETM治疗显著减小了胰腺和肝脏肿瘤的体积。


EBRGD™(177Lu-DOTA-EBRGD)
EBRGDTM是一种基于EvaTheraTM治疗诊断平台的放射治疗药物,使用Evans blue靶向表达αvβ3 整合素的脑肿瘤,包括胶质母细胞瘤和非小细胞肺癌。 调查概念验证的早期研究表明,与没有Evans blue的NOTA-RGD或DOTA-RGD缀合物相比,177Lu-DOTA-EBRGD的肿瘤吸收显著改善。此外当与PD-L1检查点抑制剂或免疫疗法联合使用时,177Lu-DOTA-EBRGD还被证明可协同延长生存期并减少结直肠肿瘤体积。 EBRGDTM靶向表达αvβ3整合素的肿瘤,主要表现出以下三点优势:

MTTI计划在2022年进行EBRGDTM的新药研究申请(IND),并进行第一阶段临床试验。 近期,MTTI与放射性制药公司Isotopia Molecular Imaging(IMI)以及放射性同位素供应商Monrol达成合作,获得无载体Lu-177的稳定供应,以支持其靶向放射治疗产品的临床开发。此外,放射性药物开发制造商Evergreen将帮助MTTI生产EvaTheraTM平台的放射性药物。
03 多管齐下,研发诊断类核药
除了治疗类核药,MTTI还有多款诊断类核药,其中FGA和TDURA为主要产品,用于肿瘤对药物治疗反应的早期检测。
FGA(18F-Fluoroglucaric Acid)
FGA(18F-Fluoroglucaric Acid)即用放射性同位素F-18标记的葡糖二酸,是一种用于评估癌症诊断和治疗的PET显像剂,属于诊断类核药。18F-FDG专门针对死细胞,除了用于早期检测肿瘤对药物治疗的反应,还可用于心血管疾病,比如急性心肌梗塞和脑卒中的早期成像。目前MTTI已获得美国专利商标局授予的18F-FDG专利。
TDURA(99mTc -hynic-duramycin)
TDURA(99mTc -hynic-duramycin)是一种能够可视化死亡细胞的显像剂。细胞死亡时,磷脂酰乙醇胺(PE)会从细胞内翻转到细胞外,因此TDURA在进入人体后和PE相结合,并发射伽马射线,可通过在伽马相机呈现垂死/已死细胞的图像,表现出高亲和力、快速穿透和清除等优势。TDURA获得了核医学与分子影像学会(MI Labs)2017年度成像一等奖和重新定义早期投资研讨会(RESI Boston)2017年度创新挑战二等奖。 MTTI已经获得了欧洲联邦药品和健康产品局(FAMHP)批准的TDOURA第一阶段临床试验申请,该试验将评估TDOUR在晚期结直肠癌(CRC)患者中的安全性、剂量测定和治疗反应。
04 国产医用同位素Lu-177及相关放射性药物未来可期
Lu-177是国际原子能机构(IAEA)推荐的治疗放射性同位素,Lu-177结合各种靶向分子实现多种全身转移的恶性肿瘤疾病的治疗是目前医学界公认具有革命性前景的方案。
2019年,我国对Lu-177的用量达到了50居里/年,年需求量增长率为30%,需求增长率在国内主要医用同位素中排名第一。但由于受到观念意识、能力瓶颈与政策障碍等多重因素的制约,长期以来,国内的Lu-177全部依赖进口。直到2020年,中国工程物理研究院研发出具有自主知识产权的无载体Lu-177产品,中国才打破了该核素一直依赖进口的局面。然而现阶段177-Lu在国内只能实现小批量生产,仅满足国内5%的需求,仍有很大的发展空间。
放射性同位素Lu-177依赖进口的现实,带来了国际供应紧缺、产品订货周期长、产品衰变损耗、价格昂贵等附属问题,使得Lu-177未能在中国临床科室得到很好的推广和应用。国际上用于治疗神经内分泌肿瘤的Lu-177标记的奥曲肽(177Lu-DOTATATE)、治疗前列腺癌的特异膜抗原抑制剂(177Lu-PSMA-617)等特效放射性药物尚未引进,我国也缺乏Lu-177对应的自主原创性放射性药物。 2021年,国家原子能机构联合科技部等7部门正式发布《医用同位素中长期发展规划(2021-2035年)》(以下简称《规划》),这是我国首个针对核技术在医疗卫生应用领域发布的纲领性文件,对提升医用同位素相关产业能力水平、保障健康中国战略实施具有重要意义。
《规划》对于Lu-177的国产化发展做出了详细的任务部署:要逐步恢复Lu-177等医用同位素的生产;掌握无载体Lu-177辐照及纯化等研制技术;开展177Lu-DOTATATE、177Lu-PSMA-617等国外临床应用成熟的放射性诊疗药物技术研发;形成3-4条Lu-177规模化生产线,年产量约5000居里。
我国Lu-177尚未实现大规模国产化,仍缺乏对应的自主原创性放射性药物,未来有望借助政策优势,实现进一步的突破。