2021年8月25日,Clarity Pharmaceuticals(简称Clarity)在澳大利亚证券交易所上市,代码为CU6。Clarity的IPO发行为他们筹集了9200万美元,实现了澳大利亚证券交易所历史上最大的纯生物技术IPO。
在IPO之前,Clarity已经完成了多轮融资,累计融资金额接近3500万美元。
Clarity为何频频受到资本青睐并成功上市,本文将对此进行介绍。
团队助力放射性药物研发+商业化
Clarity拥有2名执行董事,分别是Alan Taylor和Colin Biggin。
Alan Taylor于2013年11月加入董事会,担任执行主席。Alan Taylor拥有悉尼大学应用科学学士学位、澳大利亚证券学院的应用金融硕士学位,加文医学研究所的医学博士学位。Alan Taylor拥有大约15年的银行投资经验,在融资、并购和企业咨询方面拥有丰富的专业知识。在加入Clarity之前,Alan Taylor是澳大利亚精品投资银行Inteq Limited的执行董事。
Colin Biggin于2019年10月加入董事会,担任董事总经理兼首席执行官。Colin Biggin拥有格拉斯哥大学的理学学士(荣誉)学位和博士学位,并且拥有超过15年的放射性药物开发和商业化经验,曾在挪威肿瘤制药上市公司Algeta ASA从事转移性前列腺癌治疗产品Xofigo®(二氯化镭)的开发和商业化工作,该产品于2013年获得FDA批准。
Clarity的核心团队汇聚了来自澳大利亚国立大学、悉尼大学、新南威尔士大学等高校的人才,在放射性药物市场拥有丰富经验。此外,Clarity还组建了一个科学顾问委员会,该委员会由在放射性药物领域拥有重要研究和临床经验的关键意见领袖组成,例如前美国国防部前列腺癌整合小组主席、圣路易斯华盛顿大学医学院放射学系主任、纪念斯隆凯特琳癌症中心(MSK)放射学系研究副主席。
新型疗法与技术平台相辅相成,全力研发新型放射性药物
放射性药物也称核药,是指含有放射性同位素(核素),供医学诊断和治疗用的一类特殊药物。核药可分为诊断用核药和治疗用核药。诊断用放射性药物也称为显像剂或示踪剂,作用原理是借助药物的放射性来记录它们在人体内的位置和变化,从而获得体内目标器官或病变组织的影像或功能参数。而治疗用核药则能够高度选择性浓集在病变组织,产生局部电离辐射生物效应,从而抑制或破坏病变组织,发挥治疗作用。
根据medraysintell数据,2019年全球核药市场规模约60亿美元,其中诊断药物占据主要市场,但随着越来越多的治疗性药物上市,将推动2030年全球核药市场规模达到300亿美元左右。
目前,全球共有100多种放射性同位素(核素)应用于医学领域,其中30余种医用同位素用于疾病的精准诊断与治疗。常用于临床诊断及治疗的放射性核素包括99mTc、125I、131I、14C、68Ga、177Lu、18F、90Y、89Sr等。
区别于以往临床应用的放射性同位素,Clarity开创了一种新型的放射性药物治疗方法——靶向铜治疗诊断学(TCT),这种方法利用铜-64(Cu-64)和铜-67(Cu-67)对癌症进行诊断和治疗。
Cu-64和Cu-67都是铜的放射性同位素。其中Cu-64可用于正电子发射断层扫描(PET)和分子放射治疗;而Cu-67易于在癌细胞蓄积,能释放出可杀死癌细胞的β射线,因此可用于癌症治疗。
TCT先利用Cu-64和PET成像技术,诊断药物进入体内的位置并确认靶向,一旦确认药物实际上进入肿瘤并且是安全的,就会使用Cu-67以局部方式杀死癌症。
配对使用Cu-64和Cu-67具有三大优势:

从历史上看,由于缺乏可以安全固定同位素的合适螯合剂(类似笼子),放射性同位素铜的使用一直受到了阻碍。早期使用其他螯合剂的尝试中,同位素铜在注入体内后会脱离螯合剂被释放,然后被肝脏代谢掉,限制了同位素铜的诊断潜力并且不适合治疗应用。
针对上述问题,Clarity的SAR技术平台研发了一种适用于铜同位素,具有高度特异性和高度稳定性的螯合剂,可保留铜同位素并防止其泄漏到体内。螯合剂与靶向分子相连,该靶向分子可以发现并结合癌细胞上的肿瘤特异性受体。一旦靶向分子发现肿瘤,放射性同位素就可以在该位置发挥作用,发射辐射供成像设备追踪(诊断性放射性同位素Cu-64)或破坏癌细胞(治疗性放射性同位素Cu-67)。
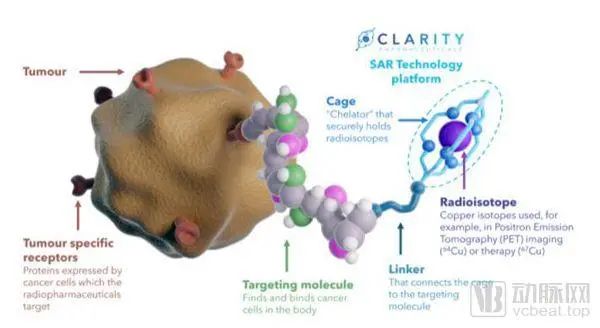
通过和靶向分子、同位素的配合,Clarity专有的SAR技术可用于开发一系列针对不同类型癌症的治疗诊断放射性药物。
三大核心产品,覆盖多种癌症类型
Clarity目前主要有三条产品线,分别是针对神经母细胞瘤的SARTATE™、针对乳腺癌和前列腺癌的SAR-Bombesin以及针对前列腺癌的SAR-bisPSMA。
■ SARTATE™
SARTATE™是Clarity的首个临床产品,也是其核心产品,适用于表达2型生长抑素受体(SSTR2)癌症的诊断、分期和后续治疗,该受体在绝大多数神经内分泌肿瘤(NET)、神经母细胞瘤以及其他儿童癌症中高度表达。
SARTATE™能够将铜的同位素直接输送到癌症病灶处,利用Cu-64和PET成像来诊断药物进入体内的位置并确认靶向。在治疗方面,则使用Cu-67以局部方式杀死癌症,SARTATE™的优势在于它能够以局部方式,在不造成任何间接伤害的情况下杀死肿瘤,最大限度地减少副作用,并提高疗效。
2020年,64Cu-SARTAT™和67Cu-SARTAT™获得FDA授予的孤儿药物指定(ODD)和罕见儿科疾病指定(RPDD),用于治疗和临床管理神经母细胞瘤。
目前Clarity正在开展SARTATE™神经母细胞瘤试验,使用64Cu-SARTAT™和67Cu-SARTAT™来评估和治疗患有高风险神经母细胞瘤的儿科患者。这是一项在美国进行的多中心、剂量递增、开放标签、非随机、I/IIa期治疗诊断临床试验。
■ SAR-Bombesin
SAR-Bombesin可以将铜同位素输送到表达胃泌素释放肽受体(GRPr)的肿瘤,并可用于诊断和治疗这些肿瘤。GRPr被证明在83%的雌激素受体(ER)阳性乳腺癌和75%-100%的前列腺癌中表达。SAR-Bombesin目前用于乳腺癌和前列腺癌的治疗诊断,未来计划用于其他GRPr阳性癌症的成像和治疗。
SAR-Bombesin的乳腺癌试验(C-BOBCAT)使用SAR-Bombesin对7名ER/PR阳性转移性乳腺癌患者进行成像,并通过治疗用品管理局(TGA)特殊访问计划(SAS)对乳腺癌和前列腺癌患者进行成像。Clarity的执行主席Alan Taylor表示,在产品给药后1、3和24小时,患者PET成像显示的高吸收和强产品保留表明67Cu-SAR-Bombesin具有巨大的治疗应用潜力。
■ SAR-bisPSMA
SAR-bisPSMA适用于表达前列腺特异性膜抗原(PSMA)癌症的诊断、分期和随后治疗。PSMA是一种在所有类型的前列腺组织中表达的蛋白质,是极好的诊断和治疗靶点。
SAR-bisPSMA的名字来源于“bis”这个词,它将两个PSMA结合基序连接到Clarity的SAR螯合剂技术以增加肿瘤在癌组织中的吸收和保留。临床前数据证实,64Cu-SAR-bisPSMA 的吸收和保留都高于市场上其他放射性药物产品使用的单一PSMA结合基序。
针对SAR-bisPSMA,Clarity展开了两项临床试验。一项是针对前列腺I/IIa期的治疗诊断试验(SECuRE),使用TCT识别并治疗表达PSMA 的转移性去势抵抗性前列腺癌(mCRPC),目的是确定67Cu-SAR-bisPSMA作为一种疗法的安全性和有效性。该试验已于21年11月完成招募工作。
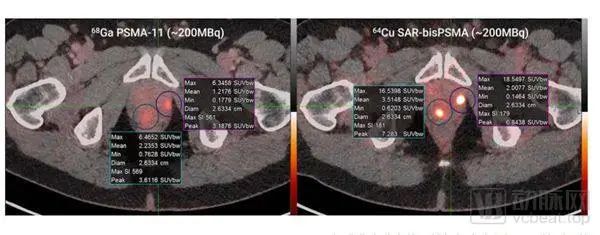
另一项是针对前列腺I期的PET成像试验(PROPELLER),计划对30名已确诊前列腺癌但还未进行前列腺切除手术的患者使用67Cu-SAR-bisPSMA进行治疗。目前,15名参与者已经完成了67Cu-SAR-bisPSMA诊断。诊断结果显示,67Cu-SAR-bisPSMA拥有比68Ga-Ma-11更高的标准化摄取值(SUVmax值)。该项试验的首席研究员Louise Emmett教授表示,更高的肿瘤摄取意味着它们在PET扫描中更明显,因此被检测到的机会更高。
全方位的知识产权战略
Clarity非常注重知识产权保护,其专利战略旨在涵盖SAR技术平台、放射性药物产品以及一项专注于开发新产品的“发现项目”,以此为现有产品提供强有力的保护,并扩大产品线。
目前Clarity已经获得了澳大利亚国立大学、墨尔本大学和澳大利亚核科学技术组织的知识产权许可,其专利组合涵盖众多国家,包括美国、澳大利亚、欧洲、日本、中国、加拿大、新加坡、马来西亚、韩国、俄罗斯、墨西哥和印度。
SARTATE™和SAR-Bombesin的专利申请已经在主要司法管辖区获得了批准和授权,SAR-bisPSMA的专利申请也已在多个司法管辖区进入国家阶段,并于最近获得美国专利商标局的授权,有效期为2038年6月5日。
通过全方位的知识产权战略,Clarity有效保护了其专有的SAR技术平台、现有产品、发现项目管道和制造工艺。
积极开展合作,保证TCT供应
Clarity积极开展合作,目前已经同爱达荷州立大学爱达荷加速器中(IAC)、ImaginAb、NorthStar Medical Radioisotopes、Evergreen Theragnostics、Cardinal Health等签订了合作协议,保证放射性同位素铜和TCT产品的持续供应。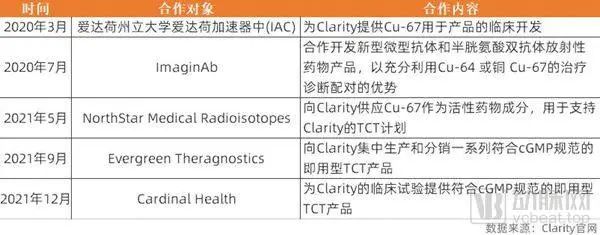
国内核药市场快速增长,医用同位素加紧国产化布局
核药发展历史已有100多年。而我国的核药则从20世纪50年代起步,相对较晚,落后于发达国家。2017年全球核药销售额达45亿美元,其中美国占38%,欧洲占24%,我国仅占不到8%。中国核药的渗透率远低于成熟市场,有着巨大的发展空间。
近年来,核医学相关科室、人才、设备的快速配置正促进我国核药产业的快速发展。
在临床普及方面,样本医院2012-2019年核药整体销售规模复合年均增长率为31%,多个主力核药品种复合年均增长率超过40%。
在核医学科室建设方面,截至2019年12月31日,全国从事核医学专业相关的科(室)达到1148个,相比2017年增加23.8%;共有12578人从事核医学相关工作,相比2017年增加38.4%。
在相关医疗设备装机量方面,正电子显像设备2019年底已经达到427台,相比2017年增加了39.1%;单光子显像设备2019年底达到903台,相比2017年增加了5.4%。
由于核药行业专业性强,技术壁垒较高,目前国内呈现双寡头竞争格局,中国同辐和东诚药业占据了中国核药大部分市场份额。根据2020年年报,中国同辐2020年核药收入29.7亿元,东诚药业2020年核药收入9.3亿元。
中国同福成立于1983年,是中国同位素及辐射技术应用的领军企业,聚焦于核药的研发、生产、销售,同时兼营放射源、辐照和独立医学检验实验室服务。中国同辐是国内最大的显像诊断及治疗用放射性药品、尿素呼气试验药盒及测试仪、以及放射免疫分析药盒制造商。旗下拥有原子高科、原子科兴、中核高通、宁波君安和中核海得威等子公司。
东诚药业成立于1998年,在2015年收购云克药业,正式涉足核药领域。当前核药业务已成为东诚的核心业务,控股的成都云克药业是中国核素药物领域首家通过GMP认证的企业,其主要产品“云克注射液”是中国首个自主研发的用于RA临床治疗的核素药物,并荣获国家发明专利;东诚欣科是中国SPECT药物生产与销售商,并拥有近距离治疗肿瘤产品碘[125I]密封籽源及临床诊断HP感染产品尿素[14C]胶囊;上海益泰医药拥有目前国内唯一一个处于临床IIb阶段1.1类治疗用核药——铼[188Re]依替膦酸盐注射液,用于恶性肿瘤骨转移的治疗。
有关医用同位素的技术突破和政策扶持,帮助我国核药市场打开了未来发展之门。
目前我国医用同位素国产化始终难以实现规模性突破。医用同位素是核药研发和生产的前提,决定了核药的药效。但目前我国核素除了少数几种外,绝大部分依赖进口,钼-99、碘-125、锶-89、镥-177等用量大的医用同位素全部依赖进口;碘-131等少部分同位素虽然实现了国产化,但无法满足国内医疗市场需求。
2020年4月,由中国核动力研究院研制生产的首批产化锶-89医用同位素正式交付成都中核高通,并经专家验证相关指标达到国际先进水平,意味着我国成功打通了锶-89研发、堆运行、辐照、产品生产全流程关键技术,解决了氯化锶[89Sr]注射液严重依赖进口的困境,正式具备氯化锶供货能力,为进一步做大做强做优国产医用同位素产业奠定了基础。
2021年,作为我国首个针对核技术在医疗卫生应用领域发布的纲领性文件,《医用同位素中长期发展规划(2021-2035年)》(以下简称《规划》)重磅发布,从产业发展供给、需求、政策三个方面部署了“十四五”期间和今后一段时期的重点任务。
《规划》提出要建立稳定自主的医用同位素供应保障体系,从加强放射性药物核高端医疗装备研发等方面提升核医疗技术水平,积极推动符合条件的放射性药物按程序纳入基本医保支付范围。《规划》的出台为我国核药市场的发展按下了加速键。
虽然我国核药行业和发达国家相比仍有相当差距,还有很多难关需要攻克,但是发展趋势整体向好。基于目前核药行业的高技术壁垒特点,以及国内产品同质化的现状,能否提前下场布局,如何快速增强新药研发实力或许将成为企业抢占市场先机的关键。