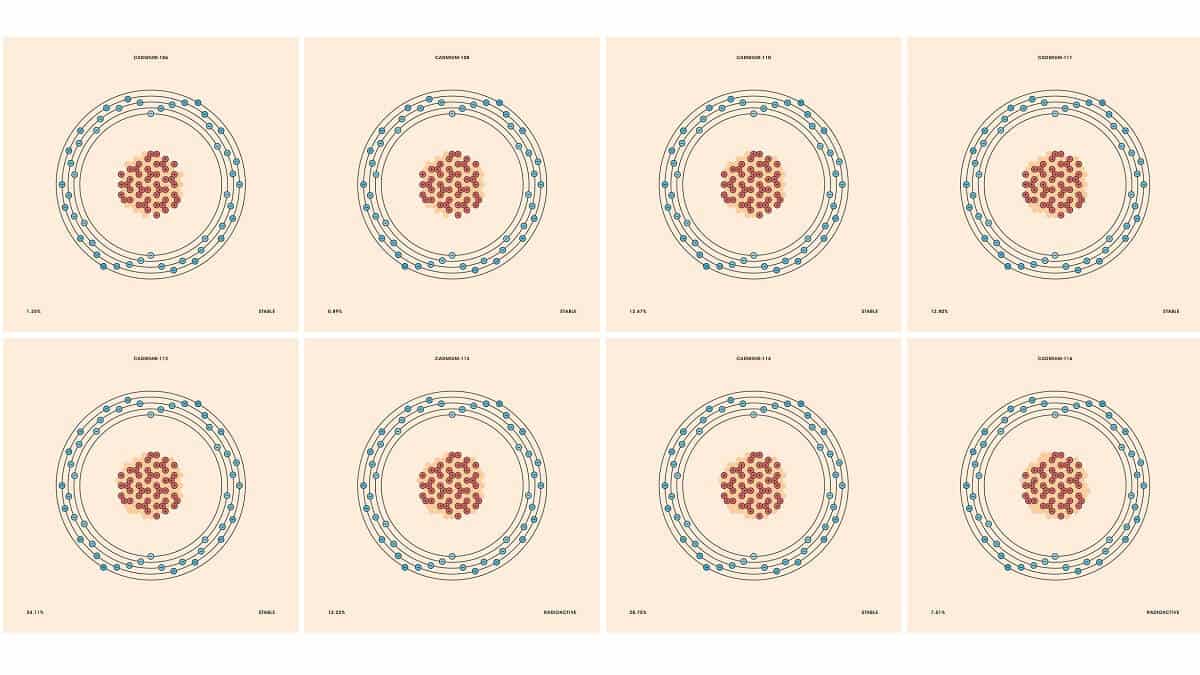
镉的一系列同位素。图片来源:Patricia F Carvalho / Getty Images
如果您是科学新闻的热心读者,您可能已经在几篇主题截然不同的文章中看到“同位素”或“同位素分析”这些词。这些主题包括地质学、天文学、古生物学、核科学、历史、生态学和化学。
那么同位素到底是什么,为什么它们在这么多不同的领域都有应用呢?
什么是同位素?
答案在于化学和原子结构。
并非所有原子都是相同的。虽然相同元素的所有原子具有相同数量的质子(根据元素周期表,氢有一个质子,氦有两个,锂有三个,依此类推),但它们并不总是具有相同数量的中子。
宇宙中大约 99.98% 的氢原子没有中子,但其余 0.02% 的氢原子大多有一个中子。因为中子的质量与质子相似,这使得这 0.02% 的氢原子质量稍大一些,或者说,在地球上,稍重一些。
这两种不同类型的氢原子被称为彼此的同位素。
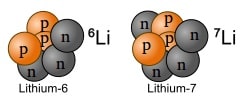
两个锂原子核。虽然两者都有三个质子,但一种同位素有三个中子,而另一种有四个。
大多数其他元素也有几种同位素。例如,大约 92% 的硅原子有 14 个中子,5% 有 15 个中子,3% 有 16 个。(还有一些微量的其他硅同位素)。
我们如何使用它们呢?
因为原子如此之多,即使是各种同位素浓度的微小差异,也可以用来获取新的信息。
例如,不同岩石之间锶同位素的浓度是不同的,这意味着不同的区域有不同的锶“特征”。去年,一组澳大利亚科学家使用这些锶特征来定位阿德莱德地区周围考拉牙齿的起源。
这也不是地球特有的情况。例如,一些美国科学家已经使用同位素来确定陨石不同部分的起源。这种同位素特征的分析结果可以非常精确。
当我们开始研究同位素的物理特性时,我们可以了解到更多。因为所有这些原子的质量都略有不同,所以在某些情况下它们的表现也会略有不同。例如,在地球上,含有较轻氧同位素的水 (H2O) 蒸发得更好,而含有较重氧同位素的 H2O 往往沉淀得更快。
这意味着,根据全球各地的蒸发量和降雨量,雨中氧同位素的浓度会略有不同。我们可以利用这些信息得出关于某个地区的气候和气候历史的结论,所有这些都是通过观察氧同位素来实现的。
生物也区分同位素。例如,一些植物在吸收二氧化碳进行光合作用时更喜欢较轻的碳原子。研究人员可以通过检查植物的碳同位素来了解植物的呼吸量。
最后,一些不稳定的同位素,放射性同位素,会分解。有时,它们在此过程中会释放大量能量:这就是核能的来源。
其他同位素分解得极其缓慢,需要数千到数十亿年才能耗尽。如果我们能算出这些放射性同位素分解需要多长时间,我们就可以利用同位素的浓度来算出事物的年龄。
这是辐射测年的基石,用于确定从岩石到人类遗骸的一切事物的年龄。
我们如何识别不同的同位素?
原子可以在被称为质谱仪的设备上进行“称重”。这台机器通过略微弯曲其路径的磁场将原子抛向探测器。质量较大的原子不太倾向于弯曲其路径,这意味着它们会在不同的点撞击探测器。
在撰写有关同位素的文章时,研究人员倾向于使用数字来区分它们。“较轻的氧同位素”和“较重的氧同位素”并不是真正足够精确的术语,特别是在使用具有两种以上天然存在的同位素的元素时。(而且重量和质量并不完全相同。)
同位素通常用一个将它们的质子和中子加在一起的数字来表示,所以没有中子的氢被称为1H,来表示它有的单个质子,而较重的氢是2H ,来表示还有一个中子。
同位素16O 有 8 个质子和 8 个中子,而稀有的17O 和18O 分别有 9 个和 10 个中子。有时,也写为氧-16 或氧-18。