
利用抗癌药物抑制癌细胞生长和分裂的常规化疗是癌症治疗的主要手段。大多数抗癌药物是非选择性的,不能在肿瘤组织中积累。为了提高化疗药的疗效或减轻副作用,多种新型纳米药物递送系统被开发用于癌症治疗。然而,抗癌纳米药物的体内药代动力学和给药过程的有限数据阻碍了其临床应用。一些近红外荧光团已被广泛用于标记药物或跟踪药物吸收、代谢、分布和治疗结果的反馈。然而,标记过程可能会改变原始药物的物理和化学性质,导致成像结果与真实药物代谢之间存在很大差异。因此,设计具有长血液循环和高肿瘤亲和力的有机荧光药物载体有重要的科学研究和应用价值。
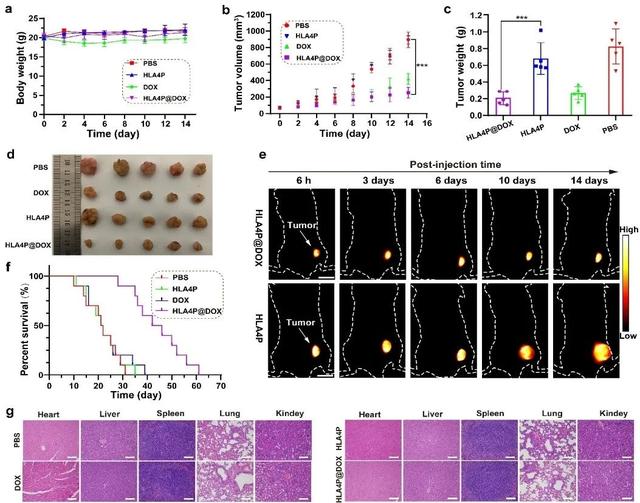
根据密度泛函理论设计、合成了一系列新型的噻吩并噻二唑NIR-II荧光团HLAn(n = 1–4),主链上的碳链从C0延伸到C12,光学能隙差可控调整为1.48 eV–1.77 eV。通过化学键修饰制备水溶性的荧光团HLAnP(n=1–4),自组装成球形或棒状胶束(1–200 nm)。HLA1P具有较短的血液半衰期,通过肾清除尿液排出;而HLAnP(n = 2–4)具有较长的血液半衰期(8.2 -70小时),最后缓慢通过肝胆清除,粪便排出。通过各种途径(静脉、腹腔、肌肉或皮下注射)给药,HLA4P在体内具有超长循环时间(t1/2 = 70 小时)、超高的成像信噪比(T/NT > 25)、超长肿瘤滞留时间(> 21天)、较少的网状内皮系统摄取和免疫原性。HLA4P可以有效地包载抗癌药物阿霉素(DOX,包封率为65%),并实现DOX的可视化精准递送和缓慢靶向释放。HLA4P@DOX与游离DOX相比,药物肿瘤滞留时间和药物释放可持续14天,表现出更好的治疗效果和减少的心脏和肾毒副作用。HLA4P@DOX可以实现长时间实时活体肿瘤治疗效果动态跟踪、给药分布和代谢NIR-II成像,本研究为诊断和治疗双功能应用的NIR-II荧光团的设计提供了新的视角。这些结果共同证明HLA4P作为一种新型NIR-II探针在精准药物递送和治疗可视化上具有极大的潜力。