
跟据放射性衰变发出射线的不同,可将治疗用放射性核素分为三类:
第一类是发射β射线的核素,根据射线在组织内的射程可分为:短射程(<200μm)、中射程(200μm~1mm)和长射程(> 1mm)。其中的一些核素已被广泛用于临床,如131I、32P、89Sr、90Y等。
第二类核素是α粒子发射体,α粒子射程50~90μm,约为10 个细胞直径的距离,α粒子在短距离内释放出巨大能量,使其在内照射治疗中有巨大的发展潜力。如223Ra主要释放具有高能量、高LET和低组织穿透性的α粒子,引起邻近的肿瘤细胞DNA双链断裂,从而产生强效、范围局限性细胞毒性,临床上已经用于骨转移的治疗。
第三类核素通过电子俘获或内转换发射俄歇电子或内转换电子,射程多为10nm,只有当衰变位置靠近DNA时才产生治疗作用。如125I发射俄歇电子和一个能量为125~155keV的内转换电子,在约一个细胞直径范围内产生与131I相似的照射剂量。
目前临床上应用核素治疗的恶性肿瘤有以下几种:
1.分化型甲状腺癌放射性核素治疗

原理:分化型甲状腺癌的原发灶和转移灶癌细胞具有正常甲状腺滤泡细胞的部分功能,其细胞膜表面具有钠/碘共转运子(NIS)并具有摄碘能力,通过NIS将131I从血液中选择性地摄入到甲状腺癌细胞及残留的正常甲状腺滤泡细胞中,利用131I衰变产生β射线的辐射生物学效应清除甲状腺癌细胞及残留甲状腺组织,达到降低肿瘤复发及转移的目的。治疗类型包括以下三种:①采用131I清除手术后残留的甲状腺组织,简称“清甲”治疗;②采用131I清除手术后隐匿的微小肿瘤病灶,称为辅助治疗;③采用131I清除手术不能切除的分化型甲状腺癌转移灶,简称“清灶”治疗。
2.转移性骨肿瘤的放射性核素治疗
肿瘤骨转移患者的主要治疗目标为:缓解疼痛,恢复功能,改善生活质量;预防和治疗骨相关事件;控制肿瘤进展,延长生存期。
(1)转移性骨肿瘤的靶向β粒子治疗:89SrCl2是目前临床上治疗恶性肿瘤骨转移应用较多的 种放射性药物,89Sr发射纯β射线。β粒子照射病灶产生辐射生物效应,使骨肿瘤微环境中水肿和炎症反应减轻,从而减轻疼痛,起到治疗骨转移的目的。

(2)转移性骨肿瘤的靶向α粒子治疗:α粒子最主要的优点是其具有较高的线性能量传递。223Ra是第一个被美国FDA批准用于临床的靶向α粒子治疗药物,用于治疗患去势难治性前列腺癌(CRPC)、有症状性骨转移且无已知内脏转移的患者。
3.放射性核素131I-MIBG治疗
131I-MIBG的化学结构与去甲肾上腺素相似,能被肾上腺髓质和交感神经丰富的组织器官摄取, 嗜铬细胞瘤和神经母细胞瘤能高度选择性摄取131I-MIBG,131I衰变发射β射线杀伤或抑制肿瘤细胞,发挥治疗作用。
4.实体肿瘤的粒子植入治疗
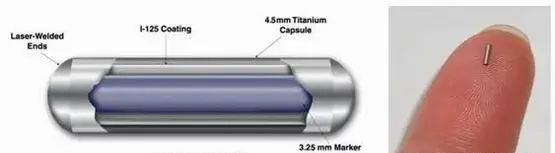
125I放射性密封粒子源结构示意图
粒子植入治疗属于近距离放射治疗的范畴,是将含有放射性核素(如125I和103Pd等)的微型封闭粒子源,按制订的术前计划以一定的方式直接植入到肿瘤、受浸润或沿淋巴途径扩散的靶区组织中,粒子持续释放低剂量率的γ射线,肿瘤靶区累积获得高剂量照射,使肿瘤细胞停滞于静止期并不断地消耗肿瘤干细胞,使其失去增殖能力。该治理靶区外的受照剂量很低,正常组织不受或仅受轻微损伤。
5.放射性药物生物靶向治疗,包括:
(1)放射免疫治疗(radioimmunotherapy, RIT)是应用放射性核素标记特异性抗体导向治疗肿瘤的方法,能使肿瘤区域内获得高照射剂量,降低周围正常组织损伤。
现阶段主要应用的抗体类型为单克隆抗体(monoclonal antibody, McAb),其具有高度的特异性和亲和力。FDA已经批准替伊莫单抗(90Y-ibritumomab tiuxetan, Zevalin)和托西莫单抗(131I-tositumomab, Bexxar)用于淋巴瘤的治疗。
(2)受体介导的核素治疗(receptor-mediated radionuclide therapy)是依据配体和受体特异性结合的特性,利用放射性核素标记的特异配体,通过配体与受体之间的特异结合,使放射性核素浓聚于病灶,达到内照射治疗的目的。药物以奥曲肽的应用最为广泛。
6.90Y微球经肝动脉导管介入治疗肝癌。90Y衰变过程中产生β射线,将90Y用玻璃或树脂等基质封装成直径约数十微米的微球,经选择性动脉插管注入肝癌供血动脉,使微球到达肿瘤血管微小动脉,不仅可阻塞肿瘤的营养血管,还可以释放射线杀伤肿瘤细胞,起到阻塞血管和内照射的双重作用。
随着学科间的交叉融合和各种技术的综合利用,放射性核素将更广泛的应用于临床恶性肿瘤的治疗。