
同步加速器扫描:ESRF 的克莱尔沃尔什将两个器官放在为 HiP-CT 成像准备的样品罐中。(提供:ESRF/Stef Candé)
对人体组织进行成像的能力,从整个完整的器官到单个细胞,都是推进我们对健康和疾病理解的关键。为了应对这一挑战,欧洲的一项研究合作开发了一种新的成像技术,称为分层相衬断层扫描 ( HiP-CT ),它使用来自欧洲同步加速器研究机构 ( ESRF )的极亮光源 ( EBS ) 的X 射线。
EBS 是第一个高能 (6 GeV)、第四代同步加速器源。它提供了世界上最亮的 X 射线源,具有以高分辨率解决微弱密度对比所需的空间相干性。使用 EBS,HiP-CT 可以对整个人体器官进行无损 3D 扫描,然后缩小到细胞水平。
“像这样跨尺度观察器官的能力对于医学成像来说真的是革命性的,”第一作者来自伦敦大学学院的克莱尔沃尔什说,“当我们开始通过 AI 技术将我们的 HiP-CT 图像与临床图像联系起来时,我们将首次能够高度准确地验证临床图像中的模糊发现。对于理解人体解剖学,这也是一项非常令人兴奋的技术,能够在正确的空间环境中以 3D 形式看到微小器官结构,是了解我们的身体结构及其运作方式的关键。”
克莱尔沃尔什及其同事使用新的同步加速器 X 射线断层扫描技术扫描捐赠的人体器官,包括来自 新冠捐赠者的肺,并在Nature Methods 上报告了他们的发现。
高分辨率扫描
使用 EBS 测试光束线 BM05,研究人员开发了 HiP-CT 所需的专业样品制备、扫描和重建方法。他们设计了一种扫描几何结构,可减少样本剂量(以避免组织损伤)、优化检测器的动态范围、减少伪影并抑制光束硬化。
对于成像,器官被固定、部分脱水并在罐中的琼脂-乙醇中稳定。该团队记录了安装在样品顶部的一罐琼脂乙醇的参考扫描,以提供可以在图像重建过程中去除的背景。这个过程消除了低频背景变化,并实现了极端的离轴局部重建。

HiP-CT 扫描是分层执行的,通常从整个器官的 25 μm/体素开始,然后以 6.5 和 1.3–2.5 μm/体素对选定的感兴趣体积 (VOI) 进行放大成像。他们的团队通过扫描完整的人肺来评估 HiP-CT 技术的性能。对于以 25、6.5 和 2.5 μm/体素记录的图像,估计的图像分辨率分别为 72±3.4、18.3±0.6 和 10.4±0.17 μm。
为了评估不同深度和距器官中心距离的扫描的一致性,研究人员分析了两个高分辨率 VOI 的图像。他们发现两者之间的平均强度或图像质量差异很小,这表明 HiP-CT 可以在肺部的任何区域以一致的质量实现高分辨率扫描。
接下来,他们对五个完整的捐赠人体器官(大脑、肺、心脏、肾脏和脾脏)进行了成像,以 25 μm/体素执行 HiP-CT,以提供每个器官的结构概览,然后对选定的 VOI 进行多次高分辨率扫描。25 μm/体素扫描清楚地识别了宏观特征,例如肺中的单个小叶、心脏的四个腔室和相关的冠状动脉。
更高分辨率的扫描成功地可视化了器官中的功能单元,并对某些特化细胞进行了成像。例如,在大脑中,HiP-CT 显示了小脑层和单个浦肯野细胞。肺图像显示小叶间隔和间隔静脉,以及终末支气管和被识别为肺细胞和/或肺泡巨噬细胞的明亮细胞大小的物体。心脏图像显示成束的心肌纤维包括单个心肌细胞,而肾脏中可见上皮小管,脾脏中可见红色和白色的髓质。
新冠相关的肺损伤
该团队还使用 HiP-CT 来研究死于新冠相关急性呼吸窘迫综合征的患者肺组织的结构变化。以 25 μm/体素成像的肺切片在肺外周包含高强度区域,与临床放射学发现一致。
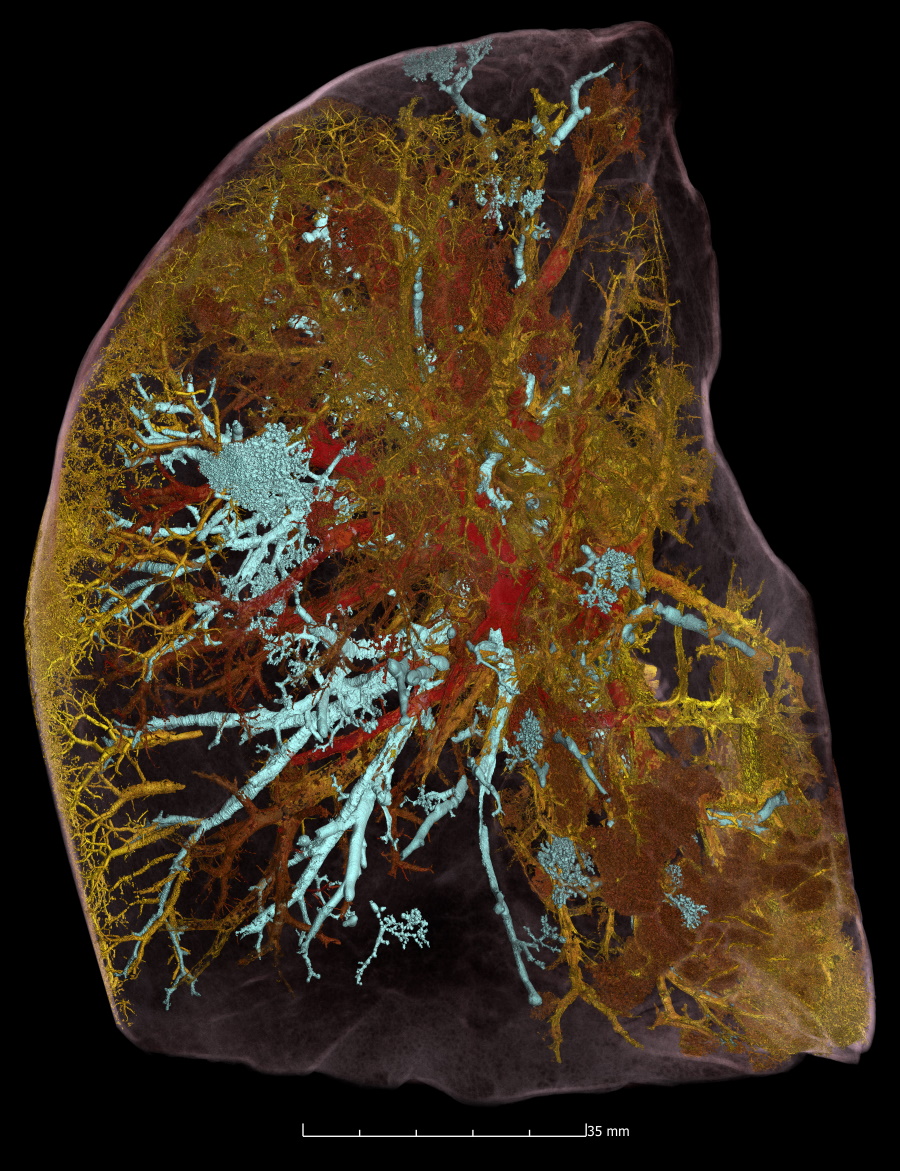
以 6 μm/体素扫描 VOI 显示异质实质损伤,一些继发性肺小叶比其他肺小叶恶化程度更大。该团队以 2 μm/每体素对受影响更严重的小叶进行了更高放大倍率的图像。扫描显示,新冠感染如何严重地重塑肺部最细小的血管,导致血液在为全身供氧的毛细血管和为肺组织本身供氧的毛细血管之间分流。这种交联阻止了患者的血液被适当地充氧——这个过程以前被假设但没有得到证实。
“通过将我们的分子方法与受新冠肺炎影响的肺部的 HiP-CT 多尺度成像相结合,我们获得了新的理解,即在新冠感染的肺部中,肺部两个血管系统中的血管之间是如何分流的,以及它的影响对我们循环系统中的氧气水平有影响,”汉诺威医学院的Danny Jonigk 解释说。
研究人员强调,随着同步加速器技术的进步,HiP-CT 将继续发展。预计明年完成一条新的 ESRF 光束线将提供几项关键进展。
“光束 [将] 更大和更高的能量,希望能够以 20 微米体素扫描整个躯干,同时仍然能够局部放大到 1 微米。增加的光束尺寸可以提高相同样品尺寸的速度,”项目负责人Peter Lee告诉物理世界。“我们希望建立一个中心,帮助我们在人体器官图谱中填充具有统计意义的健康和疾病器官数量。”