构象改变对生物大分子
(名词解释>)功能的正确表达至关重要。
补充(来源维基百科):在分子生物学里,一个蛋白质可能为了执行新的功能而改变去形状;每一种可能的形状被称为构象,而在其之间的转变即称为构象改变(英文:Conformational change)它通常会改变蛋白质的三级结构,而此结构正好是决定蛋白质功能的重要结构。构象改变可能是由许多不同的因素所造成的,如温度、配体蛋白和受体蛋白的键结等。
基于时间分辨光谱
(名词解释>)的X射线晶体学
(名词解释>)是近年来出现的一种非常成功的生物分子结构测定方法,能够准确探测、记录生物大分子的构象变化,为生物、化学的研究提供重要的参考。
时间分辨X射线衍射方法
(名词解释>)由于具有生物分子分辨率高、可在室温下进行、衍射成像效率高等突出优点,近年来已经逐渐成为生物大分子研究不可或缺的重要工具。
鉴于此,来自瑞典哥德堡大学的研究人员以“Advances and challenges in time-resolved macromolecular crystallography”为题在Science上发表综述文章。
得益于近年来X射线自由电子激光
(名词解释>)的飞速发展,X射线生物大分子的时域和空域成像也因此取得了长足的进步。在这篇综述中,来自瑞典斯德哥尔摩大学的科学家系统地总结了X射线自由电子激光对生物大分子成像所带来的变革性影响,详细阐述了该成像方法在飞秒时间尺度上卓越的分辨能力,并对时间分辨X射线晶体学未来应用过程中面临的挑战、潜在的前景做了充分的讨论与展望。
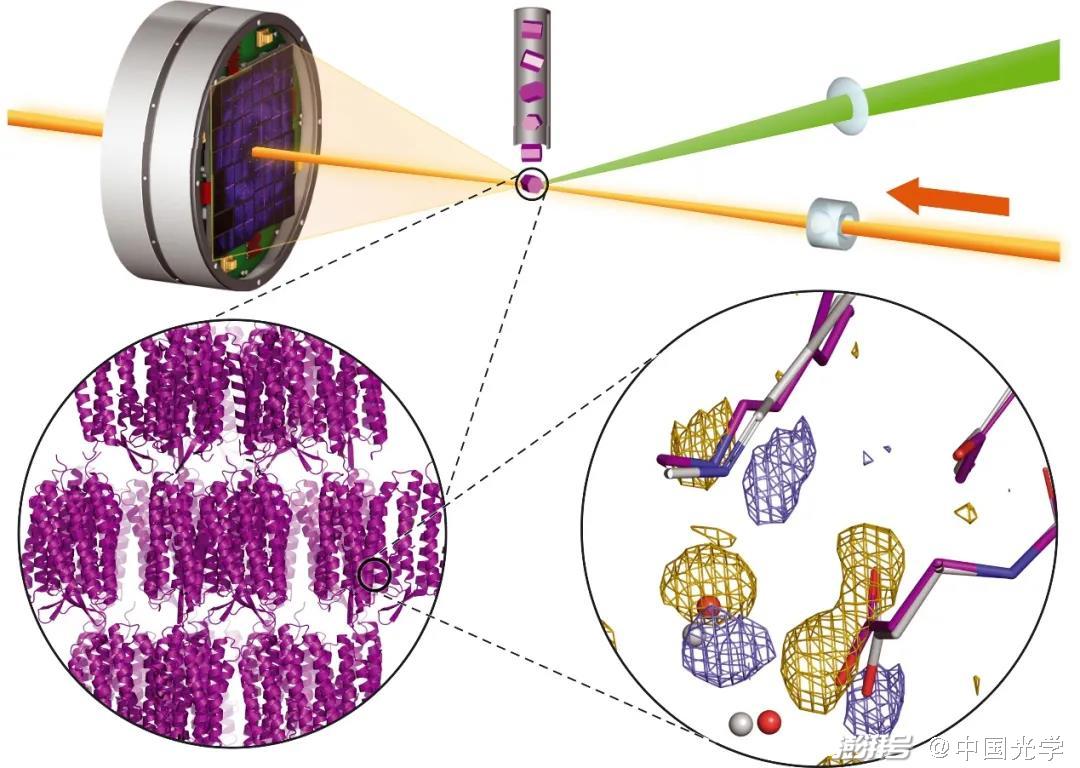 图1:光敏蛋白的时间分辨串行晶体学研究的示意图 (图源:Science 373, 980 (2021))
图1:光敏蛋白的时间分辨串行晶体学研究的示意图 (图源:Science 373, 980 (2021))
在同步辐射
(名词解释>)上使用多色x射线脉冲(Laue衍射)的数十年工作奠定了时间分辨大分子晶体学领域的实验基础。光驱动的生物反应可以使用短激光脉冲在整个晶体中快速启动,因此成为该领域的一个主要焦点。
10年前,研究人员在X射线自由电子激光器上首次实现了串行晶体学(SFX)
(名词解释>)。在这种方法中,X射线衍射数据是从一系列微晶中收集的,这些微晶的最大尺寸通常小于10μm,然后将来自数千个微晶的X射线衍射数据合并成一个完整的数据集。X射线自由电子激光串行晶体学实验的样品输送最初依赖于液体微射流,但此后发展了许多其他样品输送技术,每种技术都有其自身的优缺点。串行晶体学克服了限制时间分辨劳厄衍射的许多技术限制,从而推动了时间分辨大分子晶体学的发展。
同步加速器和X射线自由电子激光
当电子发生振荡时,它们发出电磁辐射。在大型X射线用户设施中,电子束被加速到相对论能量,并通过在阵列内以相反方向排列的周期性磁铁阵列(波荡器)(如图2)。这些交变磁场使得通过的电子发生振荡,从而产生X射线。
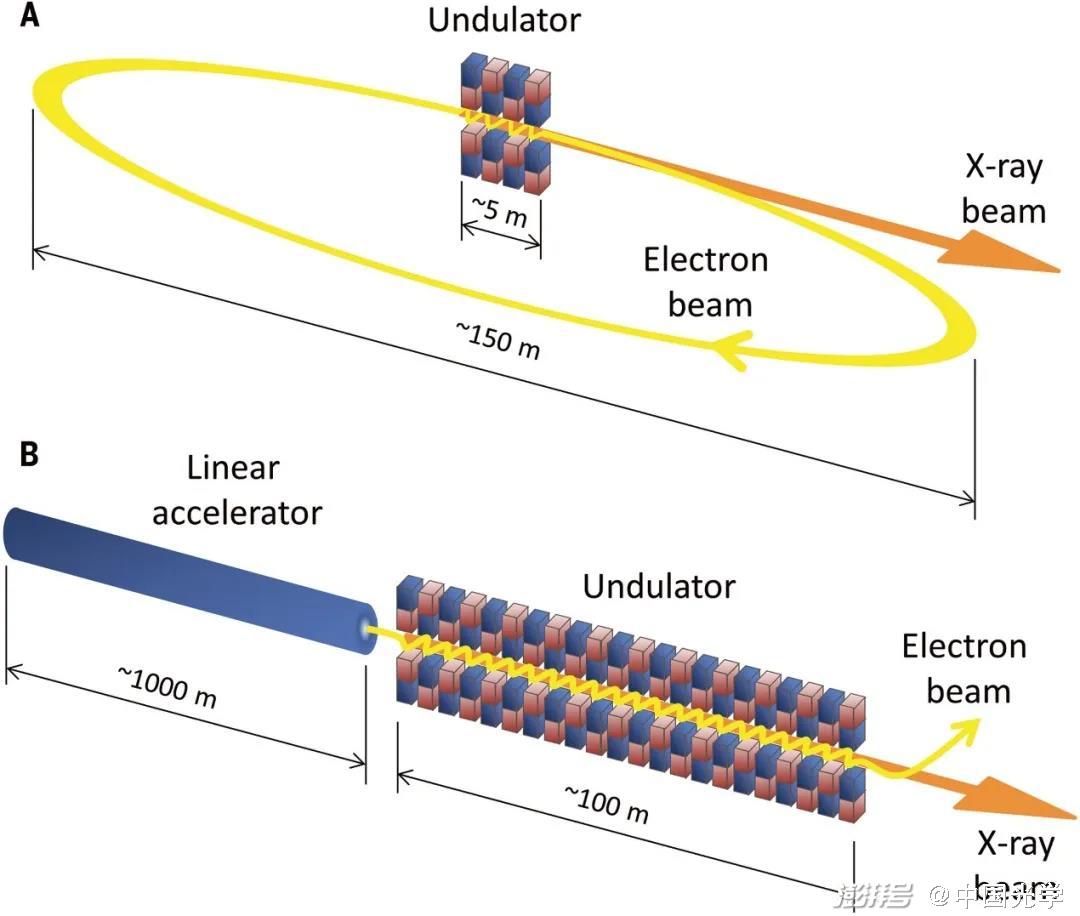 图2:X射线光源示意图。(A) 同步辐射光源 (B) X射线自由电子辐射光源 (图源:Science 373, 980 (2021))
图2:X射线光源示意图。(A) 同步辐射光源 (B) X射线自由电子辐射光源 (图源:Science 373, 980 (2021))
同步加速器是圆周通常为500到1400米的圆形机器,其中的波荡器长度一般小于5米的。由700到3400米长的直线加速器将电子引导到50到150米长的波荡器中,从而产生X射线自由电子激光。直线加速器产生的电子束比同步加速器(持续时间约100ps)要紧密得多(持续时间约10fs),因此X射线自由电子激光脉冲要短几个数量级。
X射线自由电子激光使用的较长波荡器有助于反馈机制,即波荡器早期产生的X射线与电子束相互作用,从而产生相干激光过程。激光产生的X射线光子多出许多数量级,在1Å波长下工作的X射线自由电子激光通常可以为用户实验提供每脉冲1011到1012个X射线光子。
对于大分子晶体学研究,通过使用微射流在聚焦的X射线自由电子激光光束上连续注入微米大小的晶体(微晶),可以解决样品可能被探测光源破坏的问题。以X射线自由电子激光光源的重复频率读取衍射数据,并将大量微晶的数据合并在一起就能够重建出完整的衍射数据。因为数据是使用持续数飞秒的X射线自由电子激光脉冲以串行方式收集的,所以这种方法被称为串行飞秒晶体学。
尽管历史上第一批串行飞秒晶体学结构分辨率并不高,但一旦将X射线波长接近1Å的实验站投入运行,该方法就可以迅速扩展到高分辨率成像。
串行飞秒晶体学
结构生物学家和同步辐射装置之间长达50年的合作凸显了X射线源及其使用者之间的相互依赖性。11年前,由直线加速器相干光源(LCLS)首次实现的1.5Å波长的X射线自由电子激光,对结构生物学中的生物大分子成像产生了颠覆性的影响。
X射线自由电子激光是一种革命性的光源,因为它允许极短而强烈的X射线脉冲聚焦在非常小的样本上,从而促进了许多科学领域的重大进展。
模拟预测,生物样品的原子会在X射线自由电子激光暴露过程中电离,样品会被破坏,但如果X射线自由电子激光脉冲在样品爆炸之前通过样品,则可恢复可解释的衍射数据。这一想法后来被称为“破坏前的衍射”,通过观察蛋白质晶体在70到300 fs(1 fs=10)的X射线自由电子激光脉冲下衍射功率如何下降,实验验证了这一想法−持续时间为15秒。
时间分辨串行飞秒晶体学
串行晶体学解决了许多限制时间分辨劳厄衍射
(名词解释>)更广泛应用的技术障碍。由于微晶不断被替换(图3),串行晶体学完全消除了研究系统必须返回其静止状态以循环数据收集协议的约束。通过使用准单色X射线自由电子激光脉冲,也巧妙避免了劳厄衍射易受到晶体杂质、错位等缺陷干扰的缺点该脉冲的光子能量带宽通常约为X射线光子能量的0.1%,几乎比同步加速器源劳厄衍射研究中常用的范围窄两个数量级。
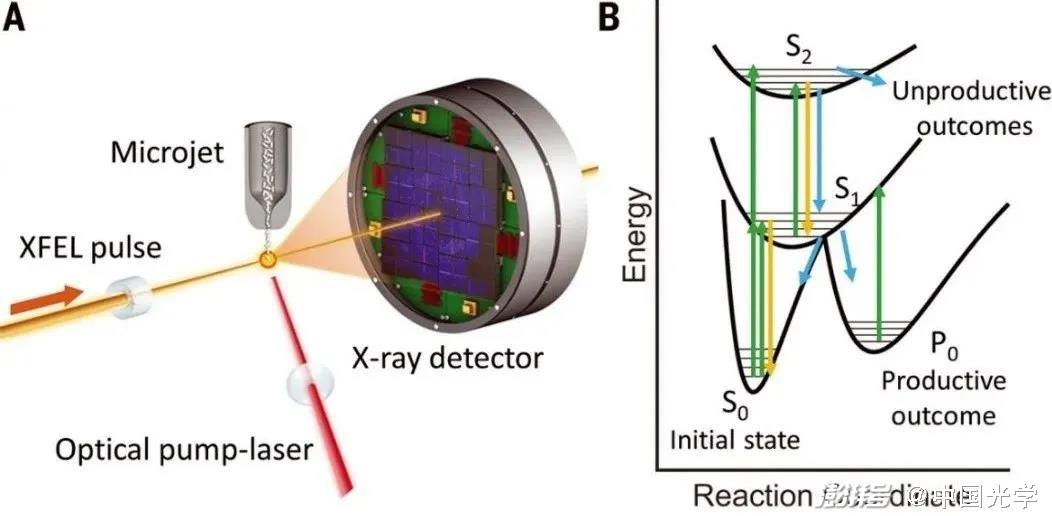 图3:光激发和多光子途径示意图 (图源:Science 373, 980 (2021))
图3:光激发和多光子途径示意图 (图源:Science 373, 980 (2021))
同时,由于X射线自由电子激光光源中的大的逐点能量和光谱波动、微晶质量的变化、晶体取向的随机取样,在使用这些数据时出现了新的挑战,在飞秒曝光期间,晶体没有时间旋转,因此只能收集部分衍射强度。时间分辨串行飞秒晶体学的一个里程碑式演示使用光敏黄蛋白(PYP)
(名词解释>)微晶对使用X射线自由电子激光辐射测量的光诱导电子密度变化与早期时间分辨劳厄衍射研究进行基准测试。
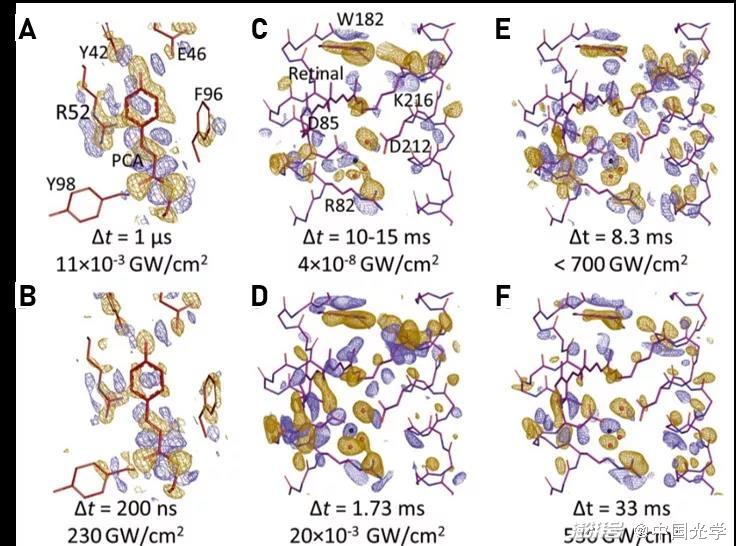 图4:基于差分傅里叶电子密度图得到蛋白质空间构型的演化图像 (图源:Science 373, 980 (2021))
图4:基于差分傅里叶电子密度图得到蛋白质空间构型的演化图像 (图源:Science 373, 980 (2021))
与使用较大晶体进行的劳厄衍射研究相比,微晶较低的光密度允许获得较高比例的光激发PYP,并且这种方法提高了观察到的电子密度变化的质量。虽然单个衍射强度测量之间的实验波动较大,但这种噪声可以通过合并大量微晶的衍射数据来减小。在实验中,利用10000到50000张经过处理的衍射图像就可以实现高质量的差分傅里叶电子密度图。
展望未来
自从七年前首次根据时间分辨串行飞秒晶体的数据计算得出高质量差分傅里叶电子密度图以来,这一里程碑大大促进了随时间变化的大分子系统结构变化的研究。时间分辨串行飞秒晶体学还开辟了超快结构生物学领域,对可视化蛋白质构象变化过程的研究产生了革命性的推动作用。
预计在不远的未来,这些进展将使该领域超越了研究光敏蛋白质的限制,并为阐明多种酶的结构机制提供了可能。鉴于目前的发展,我们相信时间分辨X射线衍射和新兴的单粒子冷冻电子显微镜方法,将会迅速发展大生物分子研究的重要实验方法,从而为活细胞的化学反应提供全新的研究工具。



