放射性药物(示踪剂)作为分子成像的“导弹”,其独特之处在于它不仅可以常规用于核医学的诊断显像(γ光子及正电子),而且还可以用于内照射治疗(α粒子或β粒子)。
过去的二十年里,几种新的放射性核素被成功地引入到临床实践中,用于诊断成像和治疗,并且诞生了一个新的方向Theranostics(治疗诊断学,或者也叫作诊疗一体化)。一般会使用一对同位素(一种用于成像,一种用于治疗),连接相似的分子靶向配体,对同一疾病进行诊断(分子成像)和治疗(分子靶向治疗)。这种伴随治疗的诊断,目的是针对患者的个性化精确治疗,这样的配对(Theranostics Pair)使得医生可以从SPECT或PET诊断获得患者特定的信息,从而量化体内功能或受体密度,从而为治疗提供精准的生物分布,剂量测定和预后。
放射性镓元素和镥元素
放射性核素诊断治疗对中,相同配体+不同核素的组合,目前最受欢迎的是镓-68 (68Ga, 半衰期68min,β+=89%,Emax=1899kev)和镥-177 (177Lu, 半衰期6.7d,Eβ-=134kev)。目前,68Ga和177Lu可以从回旋加速器或者市场上获得,更多的科研成果都进一步促进了这一对诊疗一体化核素的发展。其他和正电子显像核素68Ga共同联用的还有钇-90(90Y),以及最近用于治疗用途的α发射体铋-213 (213Bi)和镭-225(225Ac)。
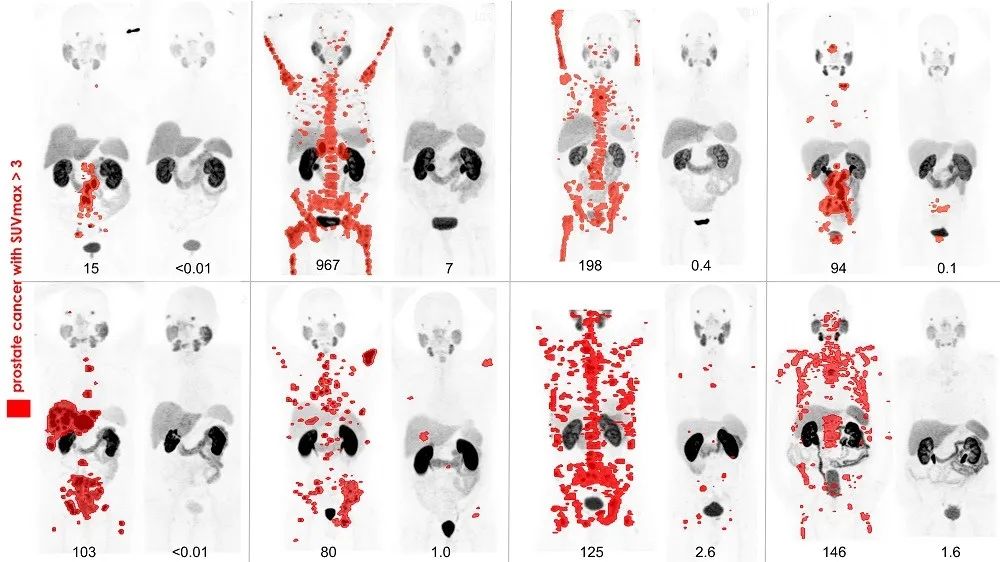 图注:北美核医学年会SNMMI 2018最佳图像,展示Lu-177 PSMA-617 对前列腺癌转移治疗后,通过Ga-68 PSMA对Lu-177内治疗前后的疗效进行成像评估,而这幅图很好的展示了治疗诊断学(Theranostic)是如何将诊断与治疗结合起来。
图注:北美核医学年会SNMMI 2018最佳图像,展示Lu-177 PSMA-617 对前列腺癌转移治疗后,通过Ga-68 PSMA对Lu-177内治疗前后的疗效进行成像评估,而这幅图很好的展示了治疗诊断学(Theranostic)是如何将诊断与治疗结合起来。
在脑胶质瘤中,用177Lu-DOTATE或68Ga-DOTATE标记的DOTA-octreotate已分别通过FDA批准用于放射靶向治疗和PET成像。
2020年,68Ga-PSMA-11通过FDA批准为第一个用于PSMA阳性前列腺癌PET成像的68Ga放射性药物。前列腺特异性膜抗原(PSMA)是前列腺癌患者诊断和治疗的重要靶点。PSMA靶向成像在指导前列腺癌的临床演变过程中具有明显的价值。使用177Lu标记的PSMA-617进行PSMA靶向治疗也同样有效,用于治疗转移性去势抵抗性前列腺癌(mCRPC)。
放射性铱元素
同一元素的不同同位素也可以组成诊断治疗对。1992年德国Jülich研究中心的一些研究人员想出了用一对相同元素的放射性核素,一个发射正电子用于成像,另一个发射β粒子用于治疗。发射β的治疗性放射性核素90Y(半衰期2.7天) 可以通过90Sr/90Y发生器系统长期提供,而86Y可以通过回旋加速器制备,半衰期(14.7小时)和它的正电子发射特性进行内照射剂量估算。
放射性碘元素
放射性碘的同位素可以说是历史上最成功的诊断治疗对之一,包括123I,124I和131I。在组合中,123I(半衰期13.2小时) 和124I (半衰期4.2天)可分别用于SPECT和PET显像诊断以及治疗前后的扫描,而131I(半衰期8.03天)用于治疗。临床上已常规用于评估甲状腺癌患者,用123I、124I,或低活度131I进行诊断性扫描后,再用高活度131I治疗。同样,肾上腺素能阳性肿瘤,如嗜铬细胞瘤和神经母细胞瘤,可以用123I-MIBG成像,然后用131I-MIBG治疗。可以根据成像图上患者的腺体大小和碘化物摄取率来计算131I的个体化治疗剂量,以便向甲状腺(残余灶)提供相应的辐射剂量。不得不说的是,尽管放射性碘治疗已经有70年的历史,在个性化剂量计算方面的优化仍在持续中。
放射性钴元素
放射性核素纯55Co和58mCo都可以通过回旋加速器制得。55Co(半衰期17.53小时,β+=77%,Eγ=931.1 keV,Iγ=75%)和58mCo(半衰期9.10小时,IC=100%)是其中最有前途的配对之一,因为它们具有相同的化学性质,加上相似的半衰期,以及与许多螯合剂具有很高的体内稳定性和相容性。有体外研究显示,Co标记的DOTATOC比68Ga和90Y标记的DOTATOC对SSTR2的亲和力更强。同样,与111In或177Lu标记的DOTATATE相比,58mCo-DOTATATE显示出更好的细胞杀伤能力。55Co和58mCo作为配对治疗药物非常适合在研究和临床环境中使用。尽管有良好的结果,目前还没有任何体内人体试验使用55Co和58mCo进行靶向放射性核素治疗,因此需要进一步的研究。
放射性砷元素
砷作为一种诊断剂有很长的历史,但是由于缺乏合适的螯合剂,以及人们对其毒性的担忧,限制了它在核医学中的使用。直到最近,新的生产方法和新的螯合剂正在上线,皮克和纳摩尔规模的放射性砷元素的使用量远远低于与毒性相关的极限,其临床作用正逐步得到扩展。砷的同位素原子质量范围从64到92,其中大多数都很短,半衰期小于24小时。其中,72As,74As,77As这几种砷同位素适合于诊断成像和放射治疗,或者同时适用于诊断成像和放射治疗。在核医学中使用时间最长的是74As。它的半衰期为17.8天,通过两条途径衰变,要么是通过正电子发射(66%)到稳定的锗-74(74Ge),最大β能量为1.54MeV,伴随的伽马辐射为595.8 keV(59%),要么是通过β发射(34%)到稳定的硒-74。β负发射的最大能量为634.8 keV(15.4%),最大β能量为1.352 MeV。74As既可以用于成像,也可以用于治疗。砷-72(72As)由于其物理特性适合于正电子发射断层扫描(PET)成像而备受关注。它发射最大能量为3.334 MeV的正电子,半衰期为26小时,衰变到稳定的锗-72(72Ge)。它还发出833keV(81%)的可探测伽马射线。它的半衰期足够长,可以与多肽和抗体配对,这些多肽和抗体需要更长的时间才能达到最大摄取,从而精确的获取患者的药代动力学和剂量学。77As作为一种治疗性同位素在核医学中具有重要意义。它通过β辐射衰变,半衰期为38.8小时,其物理特性与72As互补,从而形成配对。在该系统中,72As用作诊断成像,77As用作治疗。
放射性钪元素
钪放射性同位素可以在加速器和核反应堆中生产,其中作为正电子发射体的43Sc/44Sc和作为β发射体的47Sc,非常符合治疗对的概念。而且,43Sc、44Sc或47Sc的半衰期与相当广泛的靶向载体的药代动力学相一致。几种生长抑素类似物,或者是DOTA衍生的(DOTATOC,DOTATATE,DOTANOC),或者以NODAGA为螯合剂,都已经成功证实能被钪放射性核素标记,相容性比较好,并已经完成了一些临床前动物影像的研究,主要是用肽进行的。关于钪同位素的临床可用性,44Sc的研究比较突出,最重要的是基于医用回旋加速器的生产,其获得比较容易,还可以和47Sc以及 177Lu的治疗进行匹配。44Sc目前还被认为是68Ga的替代品。因为68Ga较短的半衰期可能会限制其在某些药代动力学研究中的应用。而44Sc可以在医用回旋加速器每天18F照射之前产生钪,并且可以很方便的使用[18F]FDG运输通道将用于放射性标记的44Sc溶液或GMP生产的44Sc示踪剂进行运送,其在医学上的应用将会越来越广泛。已经有很多临床试验比较了44Sc和68Ga的相关性。在一篇最近的研究中,与68Ga-PSMA-617相比,44Sc-PSMA-617的结合亲和力也很好,两者在体内表现出相似的行为,瘤本比等数值也与177Lu-PSMA-617有密切的相关,因此在治疗前剂量学应用中非常有前景。
写在最后
在过去的30年里,治疗性放射性核素和放射性药物的开发、生产和应用经历了许多挑战。随着分子生物学的快速发展,特异性靶向配体的研究,使用放射性核素进行诊断成像或进行局部内照射治疗将会更加个性化,更加符合我们对于未来精准医疗的预期。