要是能给抗体药物上安上化疗药物“弹头”,是不是就能更精准地打击癌细胞了?
基于此,一种被称为“生物导弹”的ADC(抗体药物偶联物)横空出世。2000年首个ADC批准上市,却一波三折后于2010年退市。
但药企和研发人员没有放弃。因为,ADC的魅力不只是强大的肿瘤杀伤力,它还有着“起死回生”的能力。
起死回生指的是药物而不是人。成为ADC“弹头”后,不少曾经因毒性太强被判“死刑”的化疗药物,迎来了施展手脚的新机会。比如曾经的美登素、海兔毒素。
可以说,ADC的出现改变了许多药物的命运。同时,ADC命运也被毒素改变着。
从化疗药物到微管蛋白抑制剂到DNA损伤剂,ADC的“弹头”经历了三代更迭,效果从最初的步枪升级为大炮,ADC也成为了药企研发热点。
截至2021年6月,国内申报临床的ADC新药已达36款。目前,全球获批上市的ADC药物也已有14款。Nature预测,2026年已上市ADC药物全球市场规模将达164亿美元。
过去几年,药企通过对“弹头”等方面的改进,已经让我们看到了ADC的无限潜力。与此同时,一个不争的事实是,还有一部分肿瘤可以阻挡弹头的攻击,我们还需要更多样的“弹头”,攻打不同的肿瘤。
人类与肿瘤的战争仍在持续,寻找最强的ADC“弹头”的任务将继续下去。
1. ADC的理想弹头长什么样?
ADC就像携带核弹头的导弹,讲究的是一击即中,打歪了可不是闹着玩的。因此,它对导弹本身的制导精确性、导弹与弹头的绑定稳固性、弹头的杀伤能力要求都很高。
换句话说,抗体+连接子+小分子毒素组成的ADC是否能成功,每一部件都很重要。
如图所示,呈“Y”字型是典型的抗体结构,其左右的“小红球”就是小分子毒素药物,抗体和药物的连接部分就是连接子。抗体作为导航系统,帮助ADC准确寻找到肿瘤细胞;毒性的小分子化合物作为ADC的弹头,在肿瘤细胞内释放,负责歼敌;连接子则负责连接药物和抗体,确保药物在到达目标地点之后再脱落,以免误伤正常细胞。
说起来简单,做起来难。仅选择ADC弹头这一问题,就难倒了不少研究人员。
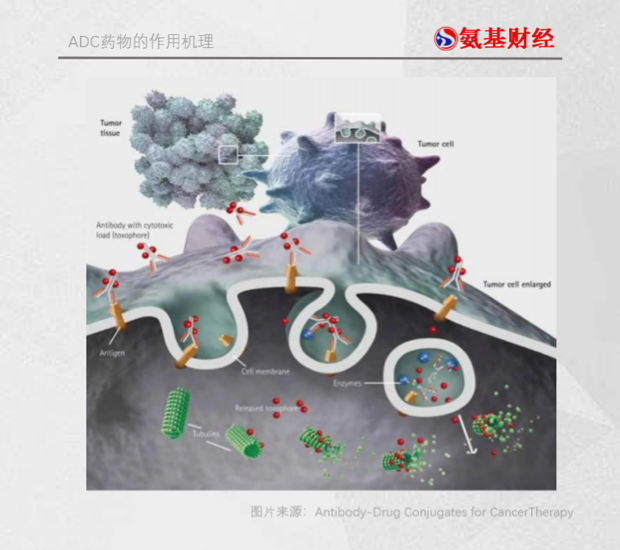
作为弹头的细胞毒药物身处与癌细胞作战的最前线,可以说ADC药物的杀伤力和副作用如何,很大一部分取决于弹头。
毒性不够,肿瘤细胞依旧可以春风快活;毒性太强,又容易殃及池鱼。因此ADC对于细胞毒药物的要求颇为严苛。要想成为ADC理想的弹头,以下这四点缺一不可。
第一,需要有较高的细胞毒性。
抗体是一个运输效率比较低的工具,在去往肿瘤细胞内部的路上,药物毒性层层降低,再经过肿瘤细胞的包吞作用后,能真正进入肿瘤内部发挥作用的弹药所剩无几。
所谓包吞,你可以理解为癌细胞吃了ADC,经过消化后,ADC的毒性自然大大降低,只有大约0.1%的药物能够抵达肿瘤细胞内部。因此想要杀伤肿瘤细胞,弹头毒性要足。
第二,需要分子量较小。
ADC毒素需要具备亚纳摩尔级别的毒性分子。这并不难理解,大分子的药物会使得ADC整体分子量增加,很可能在进入肿瘤细胞之前,先被免疫系统当作入侵者清除掉。并且,小分子的毒素行动更利索,能穿过细胞膜,从肿瘤细胞扩散到邻近的肿瘤细胞,起到旁杀作用。
第三,作用机制要清晰。
由于ADC药物的毒素是在被包吞进入肿瘤细胞后才发挥作用,因而需要毒素的作用靶向细胞内的靶点。
第四,可以被修饰。
某些细胞毒素,比如长春花碱和甲氨蝶呤偶联到抗体上后几乎失去抗癌能力,无法作为ADC的弹头。因此,一个合格的ADC弹头,必须要做到,即使采用化学方法偶联到抗体上后,仍能保留抗肿瘤活性。
基于这些苛刻条件,少有小分子毒素能入得了ADC的法眼。自2000年第一款ADC药物Mylotarg上市后,ADC经历了10年的空窗期。Mylotarg也因为连接子不稳定、弹头毒素不够等问题退出历史舞台。
不过,在未有ADC药物上市的这段时间中,研究人员一直没有放弃寻找合适的弹头。
2. 弹头升级,ADC步枪变大炮
早期设计第一代ADC药物时,研究人员曾尝试将传统的化疗药物作为毒素偶联抗体,如甲氨蝶呤、长春花碱和阿霉素。但是,由于化疗药物本身毒性不够强,和ADC结合后再经过层层消化,毒性所剩无几,甚至低于化疗药物本身的疗效,基本宣告失败。
不过,随着研究人员找到了比传统化疗药物毒性高约100~1000倍的新型高效细胞毒性化合物,ADC有了更加合适的毒素选择。
在被用于ADC的弹头之前,这些高细胞毒性化合物一度毫无用武之地。因为它们毒性都太强了,作为单药化疗使用时,在杀灭肿瘤的同时,副作用令人体难以承受。
比如美登素,它的作用机制明确,有极强的抑制肿瘤细胞增殖的能力,但同时神经毒性和胃肠道反应等毒副作用太强,临床上早已被禁止直接用于人体治疗。
甲之砒霜乙之蜜糖。对ADC来说,这些高效细胞毒性化合物,不正是ADC一直以来苦苦追寻的理想子弹吗?
于是,随着有这些高效的毒素出现,ADC也开始升级换代,靠着毒性更强的毒素,ADC的效果也由步枪升级为大炮。
升级后的二代ADC多选择微管蛋白抑制剂做毒素。微管蛋白是微管的构成,微管是细胞骨架的主要成分,使用微管蛋白抑制剂能够干扰有丝分裂,改变细胞的细胞骨架结构,导致肿瘤细胞死亡。因为肿瘤细胞分裂速度比大多数正常细胞更快,所以微管蛋白抑制剂药物对癌细胞特别有效。
简单来说,就是让肿瘤细胞无法正常有丝分裂,使其“断子绝孙”。微管蛋白抑制剂又可以分为两种,一种是以MMAE、MMAF为代表的海兔毒素衍生物,它可以促进微管蛋白聚合,使微管生长不受调控;另一种就是美登素衍生物,如DM1、DM4。
不过,由于MMAE、MMAF的细胞毒性强于DM1的细胞毒性,因此使用更加广泛。在已上市的ADC药物中,仅T-DM1一款采用DM1毒素。Adcetris、Polivy、Padcev、维迪西妥单抗均采用MMAE,Blenrep则采用MMAF。
虽然比第一代的毒素毒性强了许多,但微管蛋白抑制剂也存在一些问题。比如它只能针对处于细胞分裂期的肿瘤细胞,对非分裂和静态细胞的癌细胞,无计可施。
因此,能作用于整个细胞周期的DNA抑制剂,成了不少三代ADC的选择。
DNA抑制剂通过双链断链、烷基化、嵌合、交联等方式破坏DNA,使肿瘤细胞“严重偏瘫,半身不遂”。DNA抑制剂的代表毒素有卡奇霉素、拓扑异构酶Ⅰ抑制剂、PBD(吡咯并苯二氮卓类)等。

与微管蛋白抑制剂相比,DNA抑制剂的表现看起来更加优秀。
一方面,微管蛋白抑制剂主要作用于细胞分裂期,对不分裂的癌细胞没有杀伤效果。而DNA抑制剂能够作用于整个细胞周期,对实体瘤也具有治疗作用。
另一方面,肿瘤细胞内微管蛋白抑制剂的靶标数远超DNA抑制剂。这也就意味着,相比于令DNA停止工作,令微管蛋白停止工作需要更大的药物剂量。
而在临床效果方面,使用DNA拓扑异构酶抑制剂DXd作为弹头的第三代ADC药物DS-8201,也确实展现出了更好的效果。在与二代ADC代表T-DM1的头对头临床试验中,相比T-DM1,DS-8201让患者病情进展的风险降低了72%,死亡风险降低了45%。
3. 寻找ADC的最强弹头
当然,抗体+连接子+小分子毒素这几个因素是联动的,单独优化某一个很难起到实质性改善的作用。DS-8201也正是在小分子毒性和连接子这两方面均做了提高,使整个药物有了质的飞跃。
其中,连接子的优化升级也颇为重要。DS-8201之所以受到极高的认可,新的弹头功不可没,最关键的还是连接子的进步。有关连接子的讨论,氨基君留待下回分解。
说回ADC弹头,虽然经历三代更替,由步枪变大炮,威力大增。但目前的弹头仍存在一些局限性,比如有限的实体瘤渗透性和毒性,限制了其在实体瘤的应用。
并且与其它抗癌药一样,ADC药物也会产生耐药性。因此我们仍然需要寻找更厉害的弹头,让ADC从大炮升级到导弹。
实际上,已经有药企选择研发一些其它类型的弹头,比如免疫刺激剂、促进凋亡的BCL-xL抑制剂等。
美国Seaen-Bio公司研发的Vicineum就是使用免疫毒素作为弹头,通过破坏具有特异性标记细胞发挥药效。市场也颇为看好这一路线。齐鲁制药已经通过首付款1200万美元,后续里程碑款2300万美元,获得了这款药物在国内的权益。
艾伯维的ABBV-155则使用BcL-xL抑制剂作为弹头。Bcl-xL凋亡抑制剂是凋亡Bcl-2家族成员,其过度表达是癌细胞获得凋亡抵抗的机制之一。理论上通过阻断Bcl-xL上BH3结合域的药物可以触发癌细胞凋亡,不过该药物目前仍处于临床Ⅰ期试验阶段,效果如何还不好说。
不过,这些关于ADC弹头的创新大多来自国外药企,国内药企主要选择跟随策略,多是选择机制已经较为成熟的微管抑制剂和DNA抑制剂。
比如东耀生物的TAA013、恒瑞医药的SHR-A1201均是选择DM1作为毒素,荣昌生物的RC48、浙江医药的ARX788均选择MMAF作为毒素。
这也没错,毕竟在老路上走,不容易出错。但要想真正赢下这场ADC大战,还需要更多新的突破。
随着技术的发展,越来越多以前不可能成药的物质有了成药的可能性,ADC的弹头的可选择性也越来越多。
那么未来究竟ADC的最强弹头会在哪里出现呢?我们让子弹再飞一会。