
医疗应用中使用的放射性金属必须通过漫长的过程纯化到极高水平,并且为了最大限度地减少对患者的毒性,它们必须与称为螯合剂的分子形成络合物,这些分子被称为结合放射性金属离子。这些螯合剂中的绝大多数是通过反复试验得出的合成分子。除了这些挑战之外,锕供应链还面临着一些困难。锕极其稀有,必须在核反应堆或其他大型仪器中生产,而开发最佳螯合剂所需的元素化学知识有限。
LLNL 的科学家、该论文的第一作者 Gauthier Deblonde 说:“即使对于相对广泛使用的医用同位素,例如放射性钇,也存在这些挑战,但在锕的情况下,它们的负担更大。”
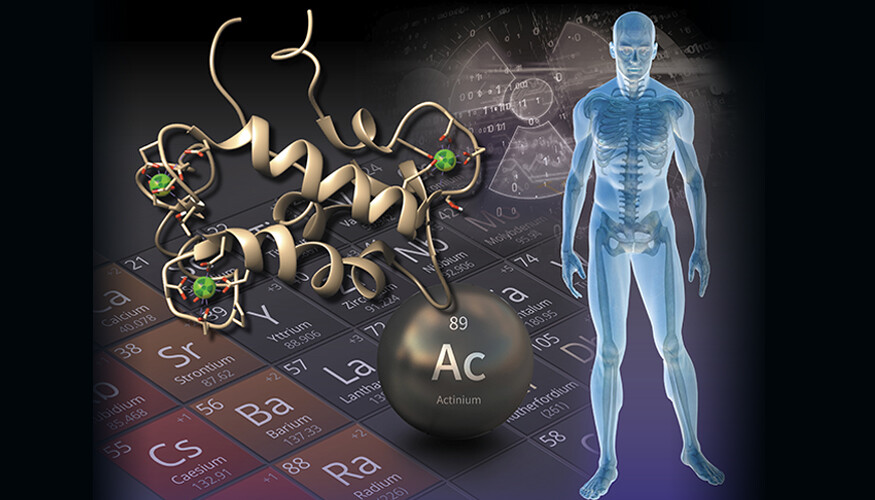
由于锕非常稀有,迄今为止,了解和利用锕化学的研究工作主要集中在重用或改造核化学领域中使用的类似已知合成分子,但结果有限。这项新研究采用了截然不同的方法,利用天然蛋白质兰莫德林,这种蛋白质特别擅长与称为稀土元素的贵金属结合。这种新策略不仅改进和简化了锕的纯化过程,而且还可用于回收和检测其他放射性元素,即使是极低水平的放射性元素。
该团队展示了如何使用 lanmodulin 结合、回收和纯化锕(一步获得至少 99.5% 的纯度),以及另一种医学相关的放射性同位素钇 90,用于癌症治疗和诊断. 基于蛋白质的方法前所未有的效率和简单性还允许以低得多的成本制备锕,并使其化学探测更加方便。该过程可能会扩展到用于放射治疗和成像的许多其他放射性同位素。
“我们的新技术不仅代表了锕化学和基于锕的药物开发方面的范式转变,而且更普遍地体现在核医学方面,”科特鲁沃说。
这项研究标志着锕第一次被表征为与蛋白质结合——如果它最终可能在人类体内使用,这是重要的知识。研究人员发现,与经典分子相比,lanmodulin 非常有效,即使在存在大量杂质(如镭和锶)或体内常见元素(如钙、锌和铜)的情况下,它也能与锕特异性结合。该研究还表明,与结合稀土元素(它在自然界中结合的金属)相比,该蛋白质在结合锕元素方面更有效。
“Lanmodulin 的紧密和特异性结合使我们能够轻松获取微量的放射性金属,而基于合成螯合剂的传统技术无法做到这一点,”Deblonde 说。“几年前,我们在这里取得的成就简直是深不可测。LLNL 和宾夕法尼亚州立大学放射化学、金属分离和生物化学技能的独特结合使这成为可能。”
该研究不仅提供了对锕基本化学的见解,而且表明锕-羊毛调节蛋白复合物可能成为新的锕药物的基础,因为羊毛调节剂在某些方面优于目前在临床和临床试验中与放射性金属一起使用的合成螯合剂。
“我们相信我们的结果统一了金属分离和生物化学领域,并具有彻底改变药物化学中几个关键步骤的巨大潜力——从纯化同位素到向患者提供治疗剂量,”科特鲁沃说。
除了 Cotruvo 和 Deblonde,研究团队还包括宾夕法尼亚州立大学的研究生 Joseph Mattocks,以及 LLNL 的 Ziye Dong、Paul Wooddy 和 Mavrik Zavarin。这项工作由 LLNL 的实验室指导研究与开发计划和能源部科学办公室资助。