新型主体分子的构建有助于超分子化学的发展,现已合成的主要大环主体分子主要包括冠醚、环糊精、杯芳烃与柱芳烃等。值得注意的是,柱芳烃类化合物由于其良好的预组织性、强非共价相互作用、易获取与易模块化等性质,使得其在不同的超分子应用领域有着广泛的应用,如:分子识别、自主装、仿生等等。因此合成新型主体分子依旧是超分子化学领域的重要研究内容。
本文介绍了一类新型超分子主体分子——janusarene,其有两个背对背排列紧凑的纳米级结合腔和独特的双面结构,可同时结合和排列客体分子,例如:富勒烯、芘、二萘嵌苯和9,10-二甲基蒽(DMA)等平面多环芳烃。作者使用X射线单晶衍射对主-客体相互作用进行了表征,发现了多环芳烃载体以双对方式充分占据janusarene纳米尺度的结合腔,这导致其光谱性质不同于溶解在溶液中或散装状态下的多环芳烃。此外,作者还合成了C1分子用于表征溶液中主客体的络合行为。Janusarene易合成、可修饰和良好的体系结构等优点使其有着更广泛的应用。
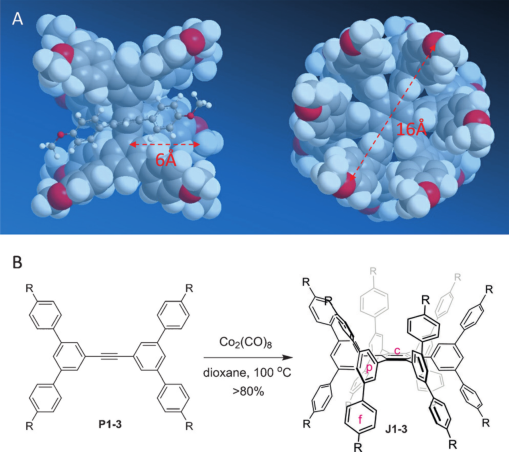 图1:janusarene的分子模型(A)与合成路线(B)
图1:janusarene的分子模型(A)与合成路线(B)
Janusarene通过两个凹芳香面以背靠背的方式结合在一起并形成了特定的空腔(图1A)。外围苯环 (p环) 沿着C—C键轴与HPB中心苯环(c环)的自由旋转受到空间位阻的限制导致janusarene构象的形成。6个苯基取代基从p环间位连接到HPB支架的每一侧。在HPB的“背部”形成两个可容纳客体的锥形空间。
通过钴催化的环三聚反应,19个苯基环(其中7个苯环构成了HPB的中间“面”,另外12个苯环围绕着该面)一步生成了janusarene。原料P1-3可通过Suzuki偶联合成。在此研究中,被甲氧基取代的J1可用于主客体络合研究,同系物J2与J3证明其可合成模块化。受到杯芳烃衍生物主客体化学识别的启发,作者推断janusarene可能通过凹凸相互作用与原始富勒烯结合,而分子建模与实验都证明了这一点。
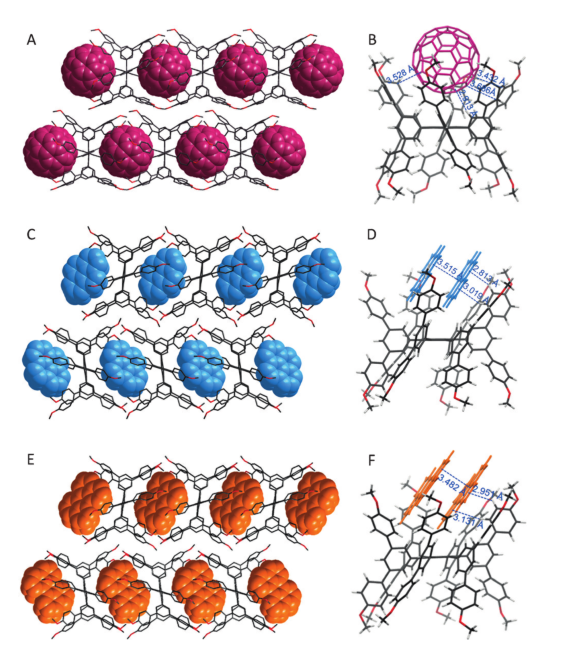 图2:J1-C60 1:1、J1-芘 1:2(C与D)、J1-二萘嵌苯1:2(E与F)的单晶衍射图
图2:J1-C60 1:1、J1-芘 1:2(C与D)、J1-二萘嵌苯1:2(E与F)的单晶衍射图
主客体复合物晶体分析揭示了J1-C60=1:1配合物的一维柱状结构(图2A,B)。客体富勒烯依偎在两个相邻的janusarene分子形成的腔内形成二价超分子组装。C60和J1的叠加周期均为14.4 Å,柱间平均距离为15.9 Å。对晶体结构的进一步检查可发现,C60和J1的所有边缘都有着密切接触且与38个s2碳原子相邻都说明了两者之间存在较强的凹凸相互作用。
此外,HPB“背”的内部质子与富勒烯体系之间的12倍C-H…π相互作用也有助于组装稳定性。作者发现janusarene可以结合和排列非球形多环芳烃(PAHs),如芘,perylene,和DMA。尽管与富勒烯相比,这些多环芳烃客体在尺寸和形状上有很大的变化,但单晶结构证实了多环芳烃客体以类似于J1-C60配合物的封装方式排列(图2C-F)。为了充分占据纳米尺度的结合腔,两分子的PAH客体平行并列在janusarene主体之间(J1: PAH=1:2,摩尔比),且二聚体在较短的面间距离内(约3.5 Å)有轻微移位,揭示主客体复合物之间有π…π相互作用。总而言之,C-H…π作用、范德华力和π…π堆积共同稳定了主客体复合物(图2D与2F)。通过主体与不同客体结合可发现结合腔的形状可微调,但总的来说独特的HPB平台构象使得janusarene的双面双凹结构得以维持。
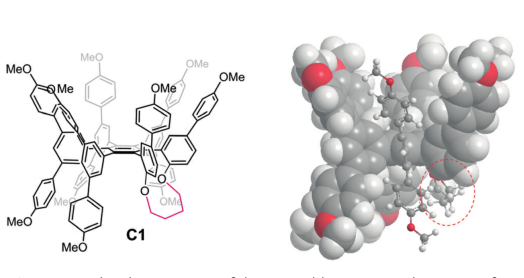 图3:C1主体的分子结构与分子模型
图3:C1主体的分子结构与分子模型
作者设计了只有一个结合腔的C1主体分子并探讨了溶液中的主客体相互作用。由C1的单体性质推测其可能形成离散的主客体复合物,而不像图2A那样。于是作者进行滴定实验量化结合现象。如图4A所示,当J1被添加到C60的甲苯溶液中时,一个宽的吸收带在450 nm处出现与变化。这一光谱变化是由于C1-C60复合物的电荷转移导致的苯甲醚-f环的电子密度增加。与此同时,实验中可观察到加入C1后的C60溶液从紫色变为棕色。与预期一致的是,通过循环伏安法可以观测到C60被络合时的还原电位发生了负移(约30 mV)。即C1具有给电子特性使得C60的电子密度增加,使其更难加入电子。
核磁滴定进一步证明了C1-C60 (1:1) 主客体复合物的形成。随着C60的滴加时,甲氧基上的质子显著地向低场移动(图4B,蓝色箭头)。与球形富勒烯相比,在甲苯、二氯甲烷、四氢呋喃和混合DCM/甲醇(1:1,v/v)等不同溶剂条件下,J1或C1与多环芳烃的客体滴定没有明显的主客体相互作用。这一结果表明,J1 - PAH复合物的形成发生在结晶过程中,并受到结晶过程的驱动。
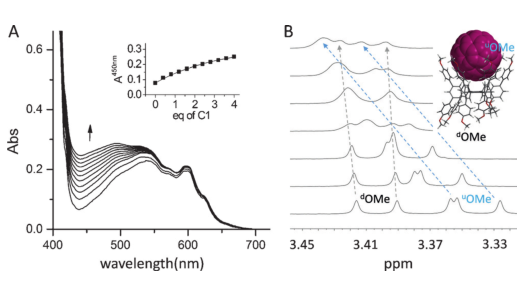 图4:加入C1后C60的紫外可见吸收光谱 (A) 与核磁谱图 (B)
图4:加入C1后C60的紫外可见吸收光谱 (A) 与核磁谱图 (B)
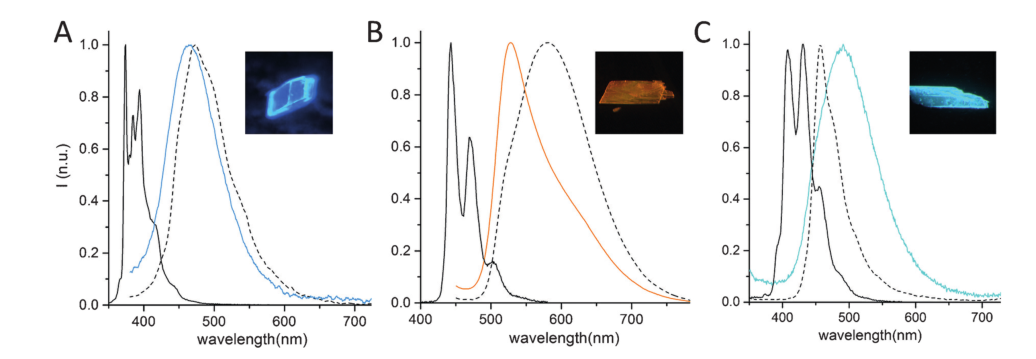 图5:芘、苝和DMA在溶液(黑实线)、本体 (黑虚线) 和主客体化合物 (彩色线)的归一化荧光光谱
图5:芘、苝和DMA在溶液(黑实线)、本体 (黑虚线) 和主客体化合物 (彩色线)的归一化荧光光谱
最后,作者在室温下观察了三种配合物中的PAH二聚体的分子发射光谱(图5)。与溶液状态相比,芘、苝和DMA的0-0波段发射分别红移约93、85和84 nm。由于发色团的取向不同,这些发射也不同于单体多环芳烃。例如,相对于单体苝在579nm发光,J1 -苝配合物因为形成了y型准分子,所以发生52 nm的蓝移在527 nm处发光。
总之,作者报道了一种合成简单的新型超分子主体分子——janusarene。由于其具有背靠背紧密排列的纳米级结合空洞,因此janusarene能够结合各种形状大小不同的客体化合物,包括球形富勒烯和平面多环芳烃等。janusarene在主客体化学、分子组装、仿生学和晶体工程等领域将有着广阔的应用前景。




