
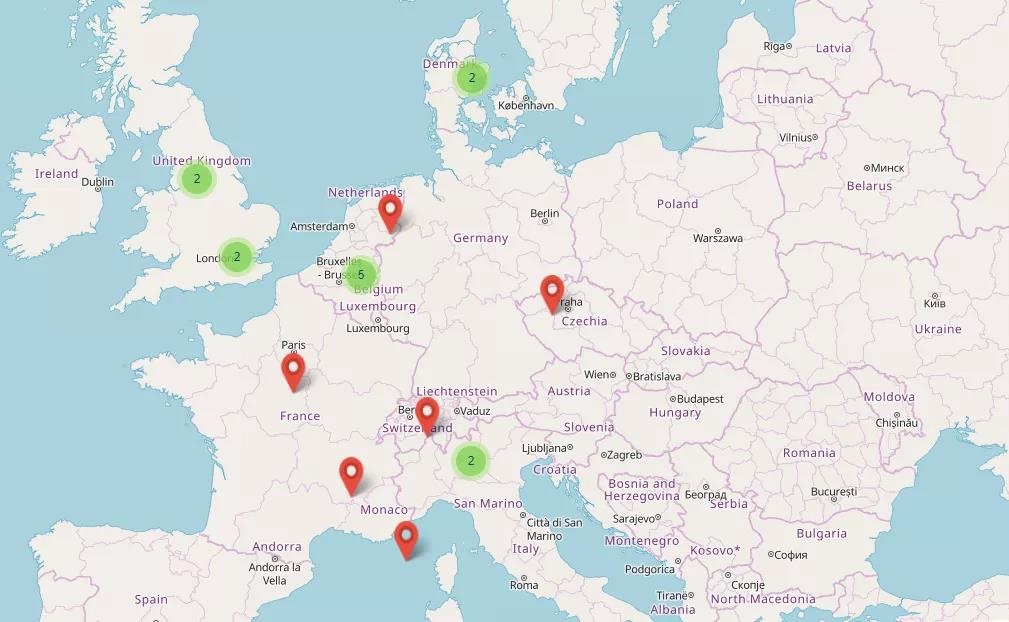
参与机构
大学/研究机构/公共机构/非盈利组织
• 丹麦奥尔胡斯大学医院(AUH)
• 荷兰格罗宁根大学医学中心(UMCG)
• 意大利特伦托APSS质子治疗中心(APSS)
• 法国尼斯癌症治疗中心(CAL)
• 法国里昂·贝拉尔癌症研究中心(CLB)
• 意大利国家肿瘤强子治疗中心(CNAO)
• 荷兰粒子治疗中心(HollandPTC)
• 法国居里研究所(IC)
• 比利时鲁汶大学(KU Leuven)
• 瑞士PSI研究所(PSI)
• 荷兰马斯特里赫特Maastro诊所(MAASTRO)
• 德国德累斯顿工业大学(TUD)
• 英国克里斯蒂NHS信托基金会(CHNT)
• 英国伦敦大学(UCL)
• 英国伦敦大学医院NHS信托基金会(UCLH)
• 英国利兹大学(UNIVLEEDS)
中小型企事业
• 丹麦奥尔胡斯大学(AU)
合作伙伴
• IBA公司
• 西门子医疗Varian公司
试验方案
试验方法
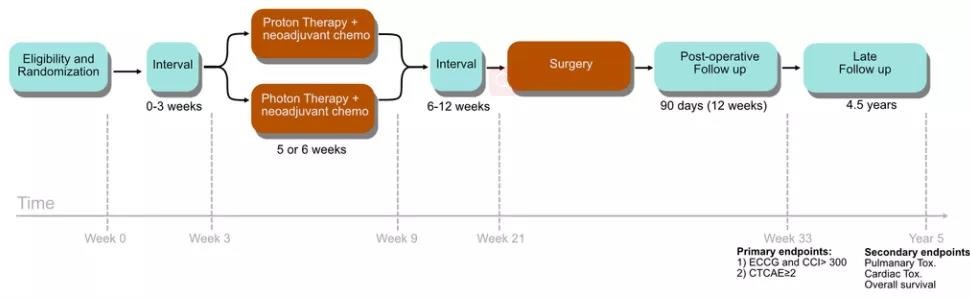
PROTECT是一项开放、非盲、国际多中心、III期随机对照临床试验,针对接受新辅助光子放化疗(nCXT)(标准治疗)或新辅助质子放化疗(nCPT)(干预)的可手术食管癌(EC)或食管胃癌(EGC)患者。nCPT与nCXT患者随机1:1分配。分层如下:
• 组织病理学(非鳞状细胞癌与鳞状细胞癌);
• 计划的手术技术(开放 vs. 微创/机器人或混合);
• 质子中心(包括分配给该中心提供nCXT的站点)。
患者及纳入标准
为避免因肺部并发症入组患者减少,考虑10%脱落,该临床试验计划招募396例患者(198例患者接受XT, 198例患者接受PT)。新诊断的食管鳞癌或腺癌患者,具可切除局部区域疾病,无远处转移,符合nCPT或nCXT的治疗标准。
治疗方案
在CROSS试验之后,nCPT和nCXT包含每周卡铂和紫杉醇化疗,持续5周。放疗处方剂量为41.4 Gy/23 fx或50.4 Gy/28 fx。实际方案的剂量水平将满足不同临床偏好和国家指南建议,以使整个欧洲机构广泛接受试验,获得最优收益,促进将试验结果广泛转化为临床实践。
主要终点
主要终点是nCPT或nCXT和手术期间及术后肺部并发症的发生率。比较两组患者发生肺部并发症的比例。从nCPT或nCXT开始到手术使用不良事件通用术语标准(CTCAE)v5.0对≥2级并发症进行评分;从手术到术后90天使用Clavien-Dindo并发症分级系统对≥2级并发症进行评分。对于未接受手术的患者,在完成nCPT或nCXT后90天内使用CTCAE v5.0对≥2级并发症进行评分。