根据发表在《放射学:人工智能》上的一项研究,华盛顿大学医学院的一组研究人员开发了一种深度学习模型,该模型能够使用单个 3D MRI 扫描将脑肿瘤归类为六种常见类型之一 。
“这是第一项针对最常见颅内肿瘤并从 3D MRI 体积直接确定肿瘤类别或不存在肿瘤的研究,”Aristeidis Sotiras 博士指导下的博士生 Satrajit Chakrabarty 说。 D. 和 Daniel Marcus 博士,在密苏里州圣路易斯华盛顿大学医学院 Mallinckrodt 放射学研究所的计算成像实验室。
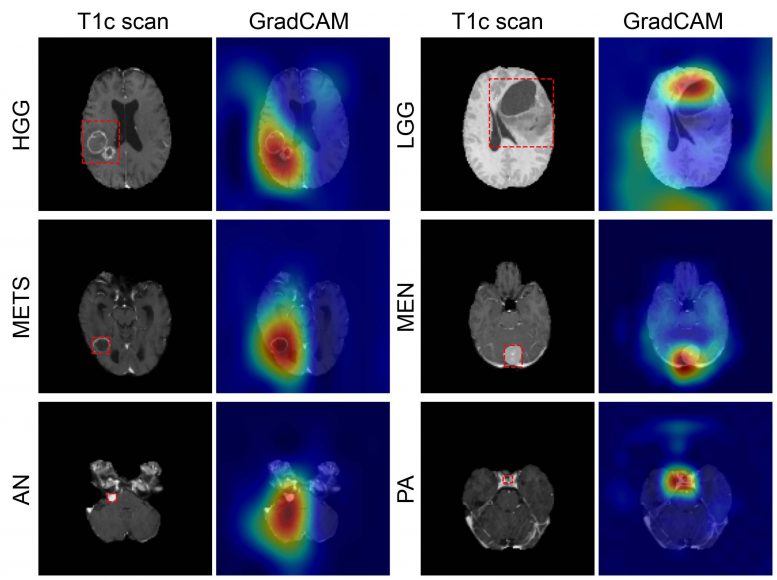
六种最常见的颅内肿瘤类型是高级别胶质瘤、低级别胶质瘤、脑转移瘤、脑膜瘤、垂体腺瘤和听神经瘤。每个都通过组织病理学记录,这需要通过手术从疑似癌症的部位取出组织并在显微镜下检查。
根据 Chakrabarty 的说法,使用 MRI 数据的机器和深度学习方法可能会自动检测和分类脑肿瘤。
“无创 MRI 可用作补充,或在某些情况下,作为组织病理学检查的替代方法,”他说。
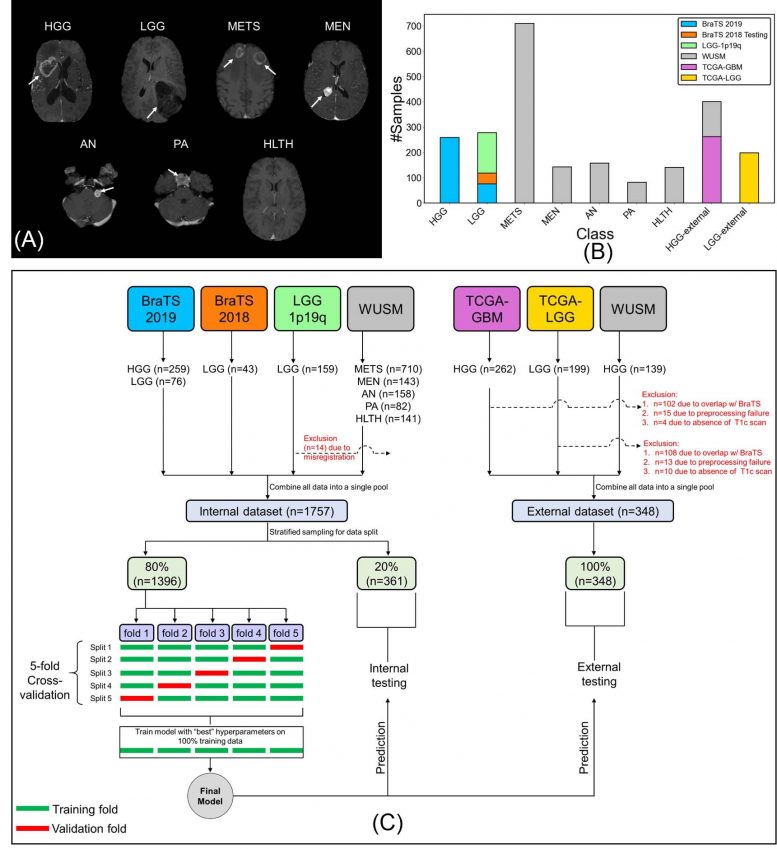
(A) 高级别胶质瘤 (HGG)、低级别胶质瘤 (LGG)、脑转移瘤 (METS)、听神经瘤 (AN)、垂体腺瘤 (PA) 的对比后 T1 加权扫描样本(轴向截面,RAS 方向) 、脑膜瘤 (MEN)、研究中包含的健康 (HLTH) 类别(白色箭头)、(B) 数据的类别分布,以及 (C) 用于交叉验证、内部和外部测试的图像和数据拆分流. BraTS = 脑肿瘤图像分割,TCGA = 癌症基因组图谱,WUSM = 华盛顿大学医学院。图片来源:北美放射学会
为了构建他们的机器学习模型,称为卷积神经网络,Chakrabarty 和 Mallinckrodt 放射研究所的研究人员从四个公开可用的来源开发了一个大型的、多机构的颅内 3D MRI 扫描数据集。除了该机构自己的内部数据外,该团队还从脑肿瘤图像分割、癌症基因组图谱多形性胶质母细胞瘤和癌症基因组图谱低级胶质瘤中获得了术前、对比后 T1 加权 MRI 扫描。
研究人员将总共 2,105 次扫描分为三个数据子集:1,396 次用于训练,361 次用于内部测试,348 次用于外部测试。第一组 MRI 扫描用于训练卷积神经网络以区分健康扫描和有肿瘤的扫描,并按类型对肿瘤进行分类。研究人员使用来自内部和外部 MRI 扫描的数据评估了模型的性能。
使用内部测试数据,该模型在七个成像类别(一个健康类别和六个肿瘤类别)中实现了93.35%(361 个中的 337 个)的准确率。敏感性范围为 91% 至 100%,阳性预测值(或筛查试验阳性的患者确实患有该疾病的概率)范围为 85% 至 100%。所有类别的阴性预测值(或筛查试验阴性的患者确实没有患病的概率)范围为 98% 到 100%。网络注意力与所有肿瘤类型的肿瘤区域重叠。
对于仅包含两种肿瘤类型(高级别神经胶质瘤和低级别神经胶质瘤)的外部测试数据集,该模型的准确率为 91.95%。
“这些结果表明,深度学习是一种很有前景的脑肿瘤自动分类和评估方法,”Chakrabarty 说。“该模型在异构数据集上实现了高精度,并在看不见的测试数据上显示了出色的泛化能力。”
Chakrabarty 表示,3D 深度学习模型通过改进现有的 2D 方法更接近于端到端、自动化工作流程的目标,现有 2D 方法需要放射科医生在机器处理之前手动描绘或表征 MRI 扫描中的肿瘤区域。卷积神经网络消除了分类前肿瘤分割的繁琐和劳动密集型步骤。
该模型的共同开发者 Sotiras 博士说,它可以扩展到其他脑肿瘤类型或神经系统疾病,有可能提供一条途径来增强大部分神经放射学工作流程。
“该网络是开发人工智能增强放射学工作流程的第一步,该工作流程可以通过提供定量信息和统计数据来支持图像解释,”Chakrabarty 补充道。
参考资料:“使用 3D 卷积神经网络对主要颅内肿瘤类型进行基于 MRI 的识别和分类:回顾性多机构分析”,2021 年 8 月 11 日,放射学:人工智能。
与 Satrajit Chakrabarty 和 Drs 合作。Sotiras 和 Marcus 分别是 Mikhail Milchenko 博士、Pamela LaMontagne 博士和 Michael Hileman 博士