质子治疗前列腺癌是一种有前途但有争议的治疗方法。尽管与光子放疗相比,质子治疗具有剂量学优势,但其对患者和保险公司增加的成本引发了人们对其价值的质疑。并且目前缺乏高水平的证据证明其可改善患者生活质量(quality of life, QOL)、降低毒性和提高患者的治愈率。已发表的多项前瞻性和回顾性研究证明质子治疗对局限性前列腺癌患者和术后需要辅助或挽救性盆腔放疗患者的有效性和安全性。
日前,国际离子治疗联合会(Particle Therapy Co-Operative Group, PTCOG)泌尿生殖系统肿瘤委员会编写《前列腺癌质子治疗共识声明》,旨在解决当前质子治疗适应证、优势、劣势和成本效益,指导前列腺癌质子治疗的临床实践和研究方向。原文发表于International Journal of Particle Therapy杂志,下面我们将部分内容整理后与大家分享。

01质子治疗的潜在优势
随着质子治疗和光子放疗两种治疗方式治疗计划和递送技术的不断完善,与光子放疗相比,质子治疗的相对优势和劣势随时间的推移而发展。这些比较结果取决于递送技术:调强质子治疗(intensity-modulated proton therapy, IMPT)/双散射质子治疗(double-scattering proton therapy, DSPT) vs. 静态调强放射治疗(intensity-modulated radiation therapy, IMRT)/动态弧形光子放疗。特殊设备的图像引导、运动管理和鲁棒优化进一步改善了疗效和成本。目前,可得出一些广泛结论,即质子在辐射递送中比光子更具优势。
首先,质子治疗降低了前列腺周围危及器官(膀胱、小肠和直肠)的放射剂量,尤其是中低剂量区(1~50 Gy)(如图1所示)。Trofimov等人比较了前列腺癌患者DSPT、IMPT和三维适形光子放疗(3-dimensional conformal radiation therapy, 3D-CRT)。制定并比较了10例患者的放疗计划,总剂量79.2 Gy(或GyRBE),每次1.8 Gy(或GyRBE)。作者发现,与IMRT相比,质子治疗显著减少了直肠和膀胱接受30 GyRBE的体积(V30)。质子治疗使直肠V30减少26%,膀胱V30减少20%。质子治疗也显著减少直肠V50,但与低等剂量相比,获益较小(28% vs. 34%; P=0.027)。Vargas等人比较了IMRT和使用笔形束扫描(pencil-beam scanning, PBS)的质子治疗,仅前列腺进行放疗,总剂量78 Gy(或GyRBE),每次2 Gy(或GyRBE)。作者为10例患者制定计划,临床靶区体积(clinical target volume, CTV)到计划靶区体积(planning target volume, PTV)的外扩轴向尺寸为5 mm,头脚方向尺寸为8 mm。在接受治疗的前列腺癌患者中,与IMRT相比,质子治疗显著减少了接受剂量10~80 Gy(V10~V80 GyRBE)的直肠体积。此外,质子治疗显著减少了接受10~35 Gy(V10~V35 GyRBE)的膀胱体积。同样,Chera等人对15例需要盆腔淋巴结照射的高危前列腺癌患者的IMRT和DSPT计划进行了比较。CTVs包括盆腔淋巴结、前列腺和近端精囊。前列腺和近端精囊CTV与淋巴结CTV序贯照射,分别为46 Gy(或GyRBE),每次2 Gy(或GyRBE)。将前列腺和近端精囊CTV推量32 Gy,总剂量78 Gy(或GyRBE)。与IMRT相比,DSPT计划显著减少了接受5~40 Gy(V5~V40 GyRBE)的直肠体积,从71%减少至53%(P<0.05)。质子治疗也显著减少了过量照射的膀胱V5~V40 GyRBE,从63%减少至40%(P<0.05)。
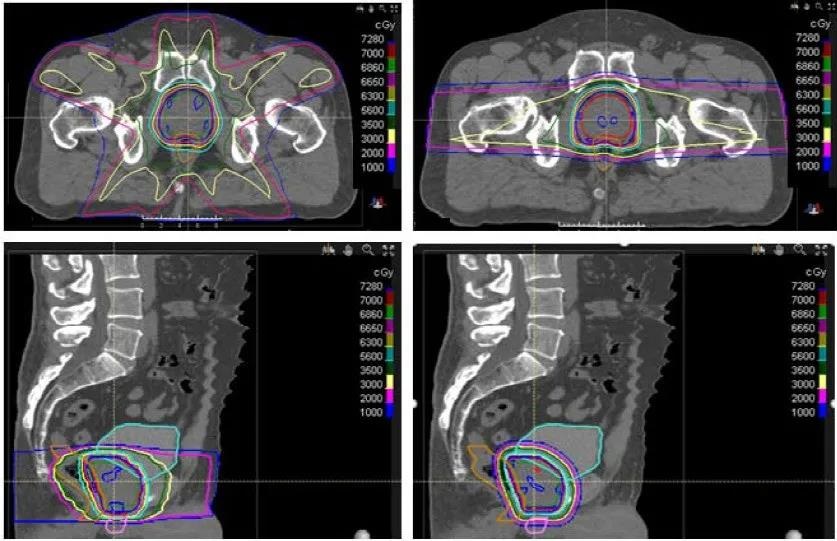
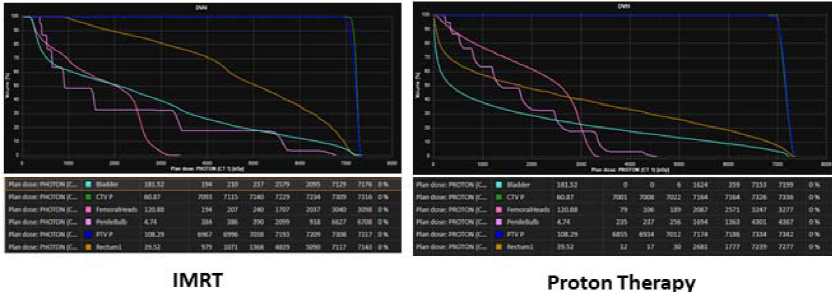
过去,研究者已经证明,中低剂量的前列腺放疗可能导致毒性反应。Vargas等人证实,在进行光子放疗时,接受50 Gy(V50)的直肠体积与2级以上长期直肠毒性相关。Pederson等人发现40%或更低的直肠V40降低了前列腺癌患者经IMRT后2级以上直肠毒性风险。下直肠中低剂量(V25~V40)也与患者报告的前列腺放疗后的GI结果相关。此外,Yahya等人发现外照射放疗后尿频率与接受41 Gy的膀胱体积有关。这些结果表明,质子治疗所允许的剂量学改进可能具有临床意义。
质子治疗可能改善辐射剂量的均匀性,尤其是PTV内。计划剂量均匀是理想的分割放疗。均匀性的计划避免了递送“热点”,即在靶区或者危及器官周围无意增加的剂量。Trofimov等人表明,在接受治疗的前列腺癌患者中,与IMRT相比,质子治疗减少了最大剂量和接受110%最大剂量以上的体积。
第三,与IMRT相比,接受质子治疗的前列腺癌患者继发肿瘤发生的风险更低。Yoon等人发现IMRT计划产生的累积剂量远高于质子治疗计划,作者预测治疗前列腺癌时,IMRT导致继发肿瘤发生的可能性是质子治疗的5倍。类似的研究中,Fontenot等人利用前列腺癌放疗后的继发恶性肿瘤风险模型分析得出结论,与IMRT相比,质子治疗可降低26%至39%的继发恶性肿瘤发生风险。Chung等人对558例接受质子治疗的患者进行回顾性队列研究,并将其与接受光子放疗的患者进行配对。在每个队列中,30%的患者患有前列腺癌。总的来说,在6.7年的中位随访中,接受质子治疗的患者患继发恶性肿瘤的风险低于接受光子放疗的患者(5.2% vs. 7.5%;危险比[hazard ratio, HR],0.52; P=0.009)。Chung等人发表的一项研究比较了从美国大型数据库诊断代码推断出接受3D-CRT、IMRT或质子治疗的各种诊断和年龄的患者继发恶性肿瘤的发生率。该研究的中位随访时间为5年,研究表明,与IMRT或3D-CRT技术相比,对于所有年龄和疾病部位(包括前列腺癌),接受质子治疗的患者继发肿瘤发生率显著降低。尽管这两项研究似乎表明质子治疗可以降低继发恶性肿瘤的风险,但两项研究均为回顾性分析,并且可能由于没有考虑可能影响癌症风险的风险因素(包括人口统计学和社会经济环境)而产生偏差。
02质子治疗的潜在劣势
与IMRT相比,质子治疗的剂量分布可能存在劣势。Trofimov等人发现IMRT比DSPT提供更好的靶区高剂量体积适形性。IMRT的平均适形指数为2.73,DSPT计划为3.11(P=0.004)。同样,在比较IMRT与DSPT时,Underwood等人发现在评估处方等剂量线时,IMRT提供比质子治疗更好的高剂量适形性。此外,与DSPT相比,IMRT直肠和膀胱接受的V50~V70体积更小。DSPT的这种不足可通过使用IMPT来消除,IMPT是一种使用PBS技术更精确的质子递送方法。Trofimov等人发现,在对前列腺进行高剂量放疗时,IMPT提供比IMRT更好的适形指数。
一些人认为,与光子放疗相比,质子束的放射生物学效应和射程存在更大的不确定性,这些可能不利于质子治疗。质子束剖面中细胞的损伤程度可能不均匀,这使肿瘤反应和毒性的预测变得复杂。尽管大多数临床中心假设质子治疗的RBE恒定为1.1,但一些研究人员发现RBE随束流角度和束流位置变化而变化。临床前数据表明扩展布拉格峰(spread-out bragg peak, SOBP)远端边缘的RBE为1.1。如果忽略这些变化,与光子放疗相比,患者可能面临更大的毒性风险。例如,若质子束停止在直肠前壁上或直肠内,直肠壁损伤可能多于标准剂量体积直方图参数预测值。相反,若利用可变RBE,若更大的RBE区域集中在大体肿瘤体积上,则可能有助于肿瘤控制。与这些潜在不确定性相关的任何不同负面影响均需与质子治疗整体剂量显著降低进行权衡。
03前列腺癌质子治疗的适应证
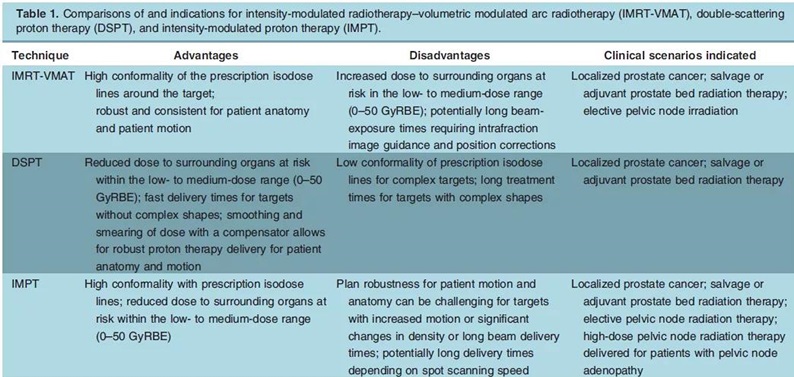
与光子放疗相比,质子治疗具有降低与剂量学优势相关的急性和晚期毒性风险的潜力,因此质子治疗在前列腺癌患者治疗中一些临床情况下适用。质子治疗前列腺癌的适应证见表1。
表1.IMRT-VMAT、DSPT与IMPT的比较及适应证
04临床试验统计
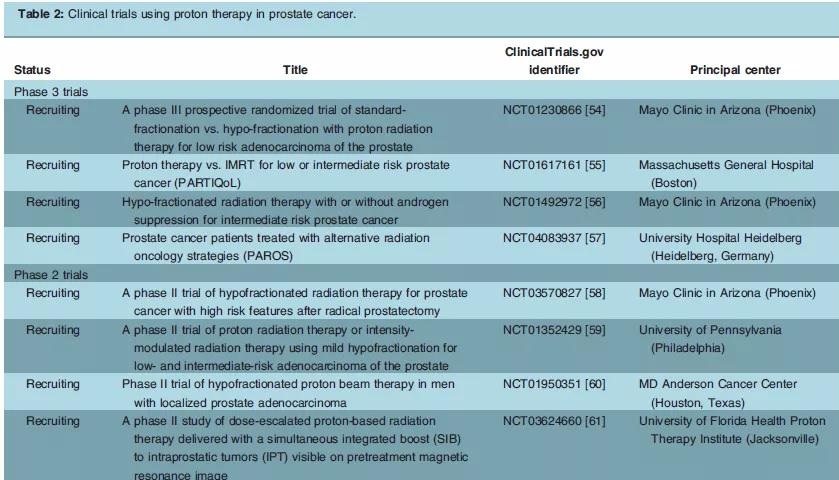
美国目前正在进行的前列腺癌前瞻性临床试验见表2,将进一步明确质子治疗在前列腺癌中的作用。
表2.质子治疗前列腺癌的临床试验
05结论
质子治疗是前列腺癌患者有效的治疗方法,与光子放疗相比,质子治疗减少了对前列腺周围正常组织的过量辐射。一些前瞻性和回顾性研究表明质子治疗在前列腺癌治疗中的安全性和有效性,一些长期随访数据已经可用,并且正在不断积累。因此,质子治疗在前列腺癌治疗中不应被认为是实验性的。对于局限性前列腺癌患者或术后患者来说是有效的。对于高危或淋巴结阳性需要盆腔淋巴结放射治疗的患者也可以安全地实施。虽然质子治疗的放射生物学不确定性尚未完全了解,但随着我们知识的增长,质子治疗的优势和局限性将变得更加清晰。不久的将来,多项前瞻性研究结果也将有助于我们理解质子治疗在前列腺癌治疗中的相对安全性和有效性。由于质子治疗的相关费用持续下降,进一步证据表明质子治疗作为一种有效的低分割治疗平台,可能是前列腺癌治疗的一种经济有效的治疗方式。(质子中国 编译报道)
参考文献Bryant C M, Henderson R H, Nichols R C, et al. Consensus Statement on Proton Therapy for Prostate Cancer[J]. International Journal of Particle Therapy, 2021.