临床超过60%的癌症患者都会接受放疗。被誉为未来放疗技术的超高剂量率辐照(FLASH-RT)近两年来引起了学界业界的巨大关注。与传统剂量率辐照(~1 Gy/min)相比,FLASH-RT(> 40 Gy/s)被认为在保证肿瘤杀伤的情况下可以大大降低对正常组织的损伤,显著提升放疗的治疗指数,实现对肿瘤更好的控制。
北京大学激光加速器利用激光驱动的离子束具有纳秒级的超短脉冲持续时间,使得10^9 Gy/s的超高剂量率辐照成为了可能,为研究极端条件超高剂量率辐照的体内和体外生物学效应提供了新的解决方案。当前国际上关于FLASH的研究较少,尤其是高达10^9 Gy/s的超高剂量率辐照效应研究寥寥无几,对正常细胞、癌细胞和癌干细胞杀伤效应的基础过程及其具体机制尚不清楚。
北京大学杨根课题组与马文君、颜学庆课题组合作,率先在国际上研究了超高剂量率FLASH辐照对正常细胞、癌干细胞和普通癌细胞的杀伤能力。2021年4月,研究结果以题为“Association of cancer stem cellradio-resistance under ultra-high dose rate FLASH irradiation withlysosome-mediated autophagy”(doi:10.3389/fcell.2021.672693)以及题为“Ultra-high dose rate FLASH irradiation induced radio-resistance of normal fibroblast cells can be enhanced by hypoxia and mitochondrial dysfunction resulting from loss of cytochrome c”(doi: 10.3389/fcell.2021.672929)连续发表在Frontiers in Cell and Developmental Biology上。两篇文章定量和定性探讨了在高达10^9 Gy/s剂量率下,单次和多次临床类似放疗剂量辐照后,细胞的凋亡,坏死和焦亡等效应的变化趋势。文章的主要结果表明:即使在10^9 Gy/s超高剂量率FLASH条件下,癌干细胞相比于正常癌细胞仍然具有显著高的辐照抗性,且可能与溶酶体介导的自噬水平增加有关;对于正常细胞的杀伤研究表明,FLASH辐照方式下正常细胞辐射抗性增强与细胞氧分压水平有显著地正相关。审稿人认为,这两项研究首次报道了在10^9 Gy/s FLASH辐照下正常细胞、癌干细胞和普通癌细胞的死亡方式和相关机制,为未来的临床FLASH治疗计划优化提供了参考。
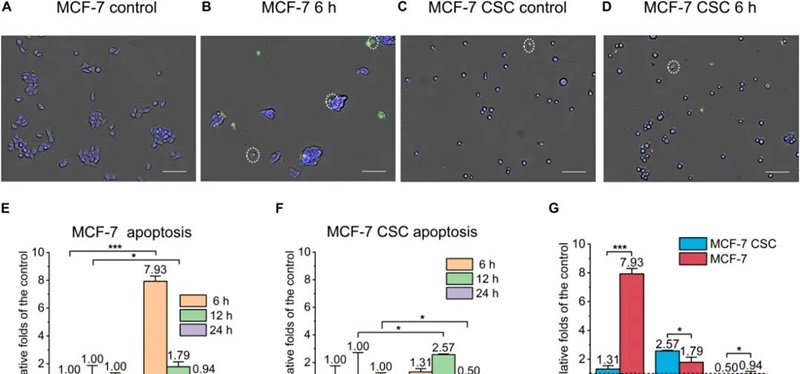
图1、FLASH辐照后人乳腺癌干细胞和普通乳腺癌细胞的凋亡水平比较
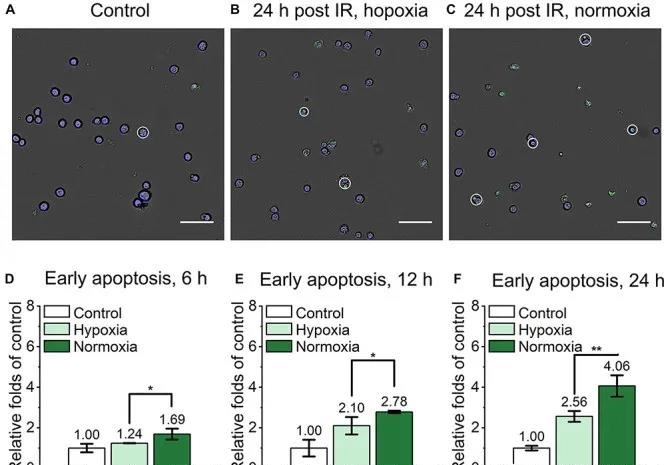
图2、乏氧和常氧下小鼠胚胎成纤维细胞FLASH辐照后的早期凋亡水平比较
杨根课题组近年来一直围绕癌症诊断和治疗的核心科学问题持续进行研究。除上述工作外,还探讨了癌干细胞(Cancer Science 111: 467-476, 2020;封面)、细胞外环境(Biotechnic & Histochemistry 95: 605-612, 2020;Biomedical Microdevices 22: 40-47, 2020)和细胞内染色质结构(Science China Life Sciences 63: 825-834, 2020)在癌症转移等过程中的关键作用;设计和开发了系列用于癌症早筛和治疗的微流控芯片(Lab on Chip 20: 4094-4105, 2020),应邀总结和展望了基于CTC的新型POC癌症诊断策略(Sensors 20, 6073, 2020);针对间皮素阳性的实体瘤(胰腺癌、间皮癌、卵巢癌、肺腺癌和三阴性乳腺癌),开发了基于抗体和放射性alpha核素At-211的特异性治疗偶联物(Journal of Radiation Research 61: 684-690, 2020)和基于正电子核素Cu-64/I-124的特异性显像探针(Molecular Pharmaceutics 17, 1875-1883, 2020,封面文章)。
这些工作获得了国家重大研发计划、国家自然科学基金创新群体项目、重点项目、面上项目、北京市卓青项目、核物理与核技术国家重点实验室开放课题和北京激光加速创新中心开放课题的资助和支持。欢迎学界和业界的老师们朋友们交流、合作和加入我们(gen.yang@pku.edu.cn;http://www.wiucas.ac.cn/recruitment/oyqyg/2021/793.html)!

