与X射线相比,质子可以更精准地杀死癌细胞,并在健康组织中沉积更少的剂量。能否通过某种方式,验证治疗计划并改善患者摆位配准?
美国北伊利诺伊大学的Christina Sarosiek博士正在研究这个问题。她解释说:“我们项目的目标是使用质子成像的方式,使质子治疗更安全、更有效。在治疗之前直接拍摄肿瘤的照片,可以知道正在照射的是肿瘤而非健康组织。”

像所有的医学治疗方法一样,质子治疗也有一些不确定性。例如,治疗分次之间的患者解剖结构变化、患者摆位的微小错位或从计划的CT扫描到质子治疗计划的校准错误,都可能导致肿瘤剂量不足或向健康组织递送剂量,而这两者都不是最佳的治疗结果。
Sarosiek博士是跨学科团队的一份子,该团队正在开发和表征原型质子射线成像系统,该系统不仅可以改进现今使用的方法,而且还可以帮助科学家和临床医生应对其它的挑战。
例如,瑞士PSI研究所的研究人员提出,可以使用射程探针(range probe)在体内验证质子射程,射程探针将低剂量、高能量的质子笔形束(一种非常细的质子束)穿过患者,然后将测得的积分布拉格峰与从计划CT获取的积分布拉格峰进行比较。但是,由于射程探针无法提供任何空间信息,也无法改善患者的对准状态,射程探针的实用性有限。
另一方面,质子成像的工作原理是向患者发送高能量但强度低的质子,然后根据所得数据重建图像。该数据将逐像素地表示为水等效厚度(即假设质子在水中,它将移动多远)。质子成像中图像对比度的来源是所传输质子的能量损失(患者体内质子阻止本领积分)。
Sarosiek博士说:“我们正在获取患者身上的积分能量图像。如果质子在递送到肿瘤的过程中,患者的解剖结构发生变化或电子密度发生变化,我们会在患者完整的积分能量图像中看到不同。”
换句话说,一旦与所计划的不同,通过质子成像,医学物理师或临床医生就能知晓,但不能精确地知道变化发生在何处。
Sarosiek博士解释说:“质子成像可以提醒我们在垂直于射束的平面内的射程差异,但是单有质子成像无法准确告知我们沿质子束路径上(即肿瘤的近端或远端)发生变化的确切位置。”
满足治疗前位置验证的图像质量Sarosiek博士和团队使用几种不同的模体对他们的质子成像系统进行了表征。研究结果发表于杂志Medical Physics。
质子成像系统结合研究小组的重建算法所产生的图像具有足够高的空间分辨率和图像质量,可帮助在质子治疗开始之前更好地靶向对准患者。
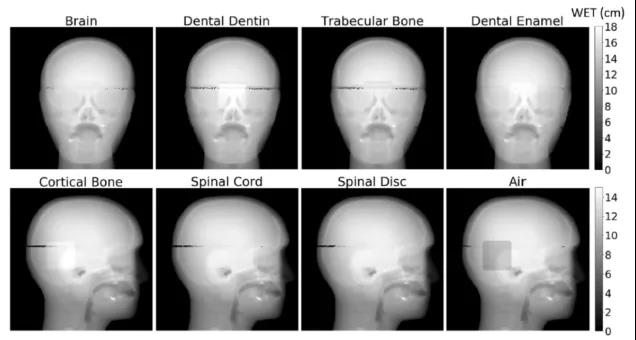
带有各种插入物的小儿头部模体的质子成像。较高密度的插入物(例如皮质骨)具有较高的水等效厚度(WET),因此在射线照片上显得更亮。较低密度的插入物(例如空气)的WET较低,显得较暗。(图片来源:Med. Phys. 10.1002/mp.14801)
结果还表明,该系统可用于检测因治疗计划CT和质子治疗计划之间患者密度变化而导致的治疗计划错误,从而帮助临床医生确保治疗质量。这些应用最终可以帮助临床医生和医学物理师在治疗计划设计时减少靶区外放。
Sarosiek博士表示,与其它依赖于定制的质子成像系统的研究结果相比,团队的研究结果具有可比性,而且该系统的一个优势是,目前正在由产业合伙人对其进行优化和商业化。
Sarosiek博士说:“从短期来看,我们的质子成像系统达到了预计目标。我认为,从长远来看,我们应当可以使用同一套设备用于成像和治疗。”
CT图像以Hounsfield单位显示,表示X射线衰减系数的转换,但质子与组织的相互作用和剂量的沉积方式不同。当前,质子放射治疗计划是使用基于X射线的CT扫描进行计划设计的,这可能导致质子治疗的一定误差。
研究人员也在努力限制这些误差。几张质子射线照片可以用来创建患者特定的曲线,将CT剂量与相对质子阻止本领(RSP)进行比较。不过,Sarosiek博士说,到目前为止,不利的一面是,研究还停留在模拟数据的基础上。
团队研究人员着眼的另一个项目是质子CT。质子CT可以让医学物理师和临床医生直接使用质子CT制定治疗计划,而无需像其他研究小组那样,生成并检验一个从CT到RSP曲线的校准曲线。未来,Sarosiek博士的合作伙伴将对此进行进一步调研。
不过,目前,在将质子成像术转变为临床用途之前,Sarosiek表示和其他研究小组将重点放在质子成像最直接的一个局限性上。
“该方法的主要限制之一便是对于质子成像,我们需要高能量、低强度的质子束。但是临床质子治疗束具有更高的强度和更低的能量,”Sarosiek表示说道,“这意味着任何集成的质子成像和治疗递送系统都将需要机载束流监控系统来分析低强度成像束,以确保对患者的剂量保持较低水平。一旦解决了这个问题,质子成像就可以进入临床实践阶段。”