诺华(Novartis)近日宣布,通过与分子成像诊断和技术开发商SOFIE Biosciences附属公司iTheranostics的一份转让协议,获得了开发和商业化成纤维细胞活化蛋白(FAP)靶向剂库(包括FAPI-46和FAPI-74)治疗应用的全球独家权利。FAP资产最初由海德堡大学开发。该协议还包括诺华为这些资产开发成像应用程序的共同专有权。
成纤维细胞活化蛋白(FAP)是一种在大多数正常成人组织中低水平表达的细胞表面蛋白,但在常见癌症中过度表达,特别是在形成肿瘤基质的癌相关成纤维细胞上,而肿瘤基质是肿瘤生长所必需的。癌相关成纤维细胞上FAP的高表达通常与实体瘤的不良预后相关,因为它促进了肿瘤的发生和发展。
诺华肿瘤学总裁Susanne Schaffert博士表示:“我们继续投资于放射配体疗法,将其作为诺华肿瘤学四大独特平台之一。我们相信跨多种方法的工作是重新构想癌症护理的关键。FAP是一个令人兴奋的靶点,这些制剂非常适合我们的放射配体疗法管线。目前在该管线中,我们正在积极研究多种肿瘤类型。我们相信这项技术有潜力改变许多患者的生活。”
靶向性放射配体疗法是一种结合了2种关键元素的精准药物:一种靶向化合物或配体和一种放射性同位素,可导致DNA损伤,抑制肿瘤生长和复制的。这些靶向药物与某些肿瘤或肿瘤相关组织(如基质)过度表达的标记物或蛋白质结合。由于这些药物对特定肿瘤细胞或相关肿瘤组织的高亲和力,对周围健康组织的影响较小。
诺华已在由4个放射配体疗法生产基地组成的网络中建立起了全球专业知识和专业供应链及制造能力,并进一步提高了供应能力,以确保向有需要的患者提供放射配体疗法。
值得一提的是,诺华是唯一一家正在建设4种不同癌症治疗平台的制药公司,包括放射配体疗法、细胞和基因疗法、靶向疗法、免疫疗法,该公司有机会将这些平台结合起来,为每位癌症患者带来最佳预后。
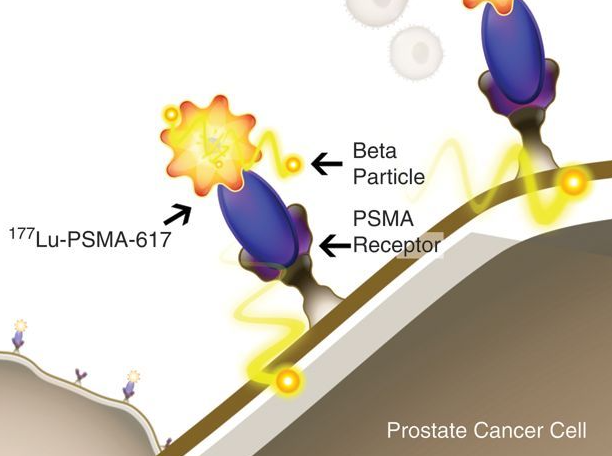
就在最近,诺华公布了靶向放射配体疗法177Lu-PSMA-617治疗PSMA阳性转移性去势抵抗性前列腺癌(mCRPC)患者III期VISION研究的首批可解读结果。该研究在831例先前接受紫杉烷和雄激素受体导向疗法(ARDT)治疗后病情进展、PSMA-PET扫描阳性的mCRPC患者中开展,评估了177Lu-PSMA-617(每6周一次静脉输注7.4 GBq,最多6个周期)联合研究调查员选择的最佳标准护理(BSC)的疗效和安全性,并于单用BSC进行了比较。该研究的替代主要终点为放射学无进展生存期(rPFS)和总生存期(OS)。
结果显示,该研究达到了2个主要终点:与BSC治疗相比,177Lu-PSMA-617联合BSC治疗显著提高了PSMA阳性mCRPC患者的OS和rPFS。结果进一步接近为80%以上晚期前列腺癌患者提供一种创新靶向疗法的目标。安全性分析与先前临床研究报告的数据一致。VISION研究的结果将在即将召开的医学会议上公布,并将纳入美国和欧盟的监管申请文件中。
前列腺癌(图片来源:hopkinsmedicine.org)
前列腺癌是一种发生在前列腺中的癌症,前列腺是男性骨盆中一种小的核桃形腺体。在去势抵抗性前列腺癌(CRPC)中,尽管使用了降低睾丸酮的激素治疗,肿瘤仍有生长迹象,如前列腺特异性抗原(PSA)水平升高。在转移性CRPC(mCRPC)中,肿瘤扩散到身体的其他部位,如邻近器官或骨骼,对激素治疗仍无反应。mCRPC患者的5年生存率约为15%。
尽管在前列腺癌治疗方面取得了进展,但对于mCRPC患者来说,对新的靶向治疗方案仍存在着非常高的未满足医疗需求。超过80%的前列腺癌肿瘤高度表达一种称为前列腺特异性膜抗原(PSMA)的表型生物标记物,这使其成为一种有前途的诊断靶点(通过正电子发射断层扫描[PET]扫描成像)和放射配体疗法的治疗靶点。
177Lu-PSMA-617是一款PSMA靶向性放射配体疗法,开发用于治疗转移性去势抵抗性前列腺癌(mCRPC)。该药是一种结合了靶向性化合物(配体)和治疗性放射性同位素(放射性粒子)的精准癌症治疗方法。在注入血液后,177Lu-PSMA-617与表达PSMA(一种跨膜蛋白)的前列腺癌细胞结合,因此肿瘤与正常组织相比对药物的摄取率高。一旦结合,来自放射性同位素的辐射(β粒子)就会损伤肿瘤细胞,破坏它们的复制能力和/或触发细胞死亡。放射性同位素的辐射仅在很短的距离内发挥作用,以限制对周围细胞的损害。