125I
介 绍
常用放射性碘包括:125I(半衰期60.14d,可用于SPECT成像),131I(半衰期8.04d),124I(半衰期4.18d,可用于PET成像)。125I/131I/124I适用于多肽,抗体或蛋白类药物的标记,适用于大分子药物组织分布研究。
原理(以125I为例)
氧化反应:在氧化剂的作用下,可以将125I- 氧化成125I2。
碘化反应:125I2可以置换酪氨酸残基苯环上羟基邻位的氢原子,使其碘化为单碘酪氨酸或双碘酪氨酸。
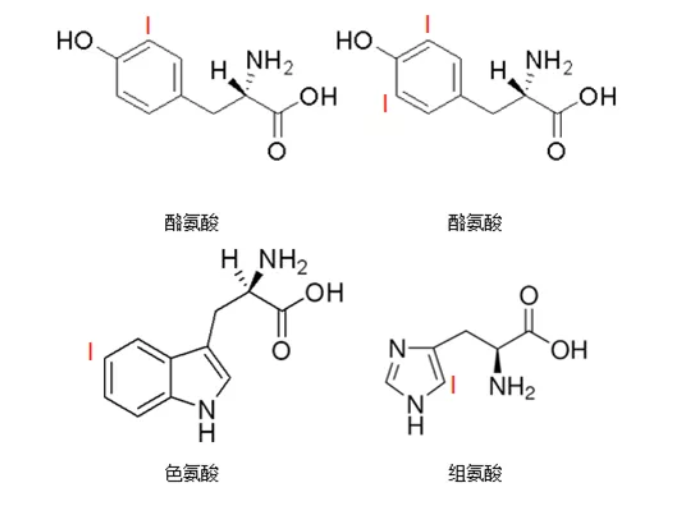
一般情况下,碘化反应只能发生在蛋白质或多肽的杂环氨基酸上(如下图所示),且以空间结构中暴露的酪氨酸残基为主,酪氨酸最容易标记,其次是色氨酸和组氨酸。
标记方法
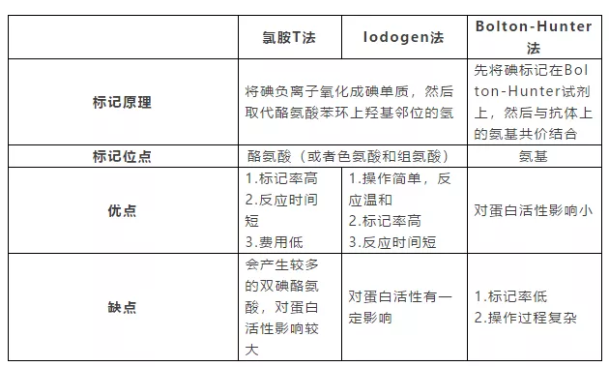
(1)氯胺T(Ch-T)法
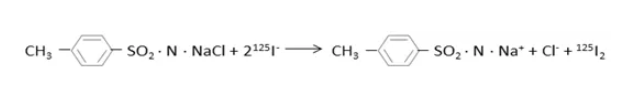
氯胺T全称对甲苯磺酰氯胺钠,其氧化碘负离子的反应式如下:
该反应需要中性的反应环境,在加入氧化剂(氯胺T)后,反应立刻开始,且反应速度很快,因此需及时加入过量的偏重亚硫酸钠终止反应。反应结束后用凝胶层析法去除氯胺T、偏重亚硫酸钠和剩余的125I,得到碘化蛋白产物。
(2)Iodogen(氯甘脲)法
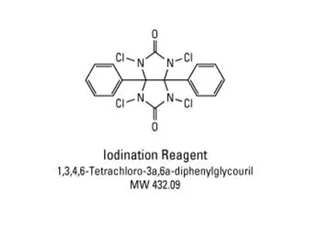
Iodogen全名1,3,4,6-四氯-3α,6α-二苯基甘脲,是一种固相氧化剂,使用时涂抹在反应管底部,可直接用于蛋白质的碘化反应。
Iodogen管中加入待标记蛋白溶液和125I溶液,反应直接开始。室温混合反应约10 min后,从Iodogen管中取出反应液,反应即终止。凝胶层析法去除剩余的125I,得到125I- 蛋白产物。
(3)间接标记(Bolton-Hunter)法
由于直接标记法的化学原理是直接作用于酪氨酸,因此用该类方法标记无法避免对主要活性结构包含酪氨酸的蛋白的破坏。因此,可以采用作用于其他位点的间接标记法来避免上述问题。间接标记法有很多种,发明最早、应用最广泛的是Bolton-Hunter法。
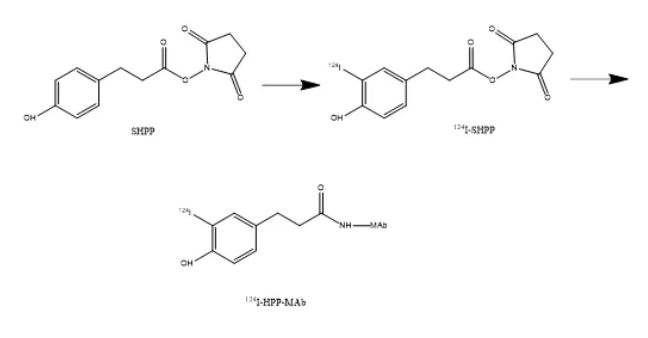
Bolton-Hunter法的原理是先将碘标记在Bolton-Hunter试剂的苯环上(直接标记法),再将标记试剂与蛋白游离的氨基偶联。
(4)不同碘标记方法比较
89Zr
介 绍
89Zr的半衰期为78.4h,平均正电子能量0.389 MeV,物理半衰期与单抗或单抗片段的生物半衰期相匹配,是PET免疫显像的理想核素,适用于抗体药物活体组织分布研究。
抗体标记
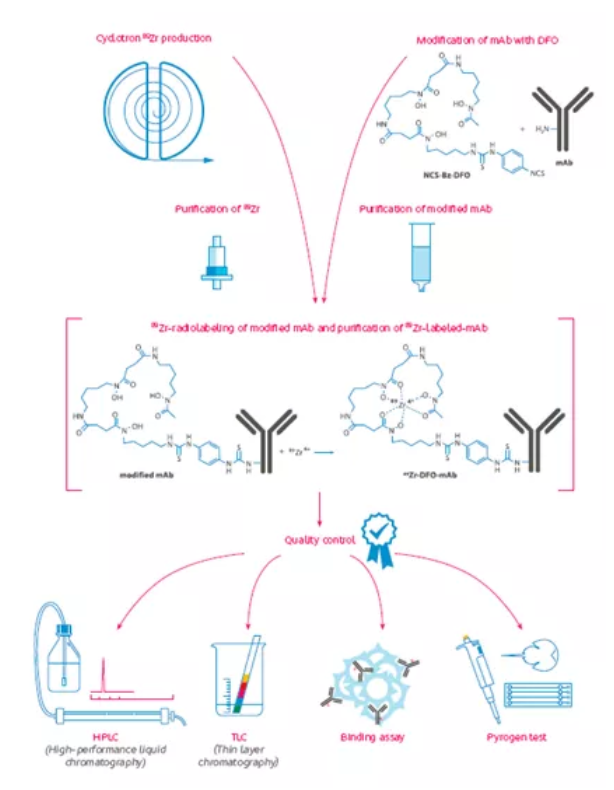
DFO-Bz-NCS的Bz-NCS基团可以和抗体的游离氨基发生偶联反应形成稳定的硫脲键,DFO的三个异羟肟酸基团可以与89Zr4+ 离子发生螯合反应,最终使抗体标记上89Zr,标记流程如下图所示。
细胞标记
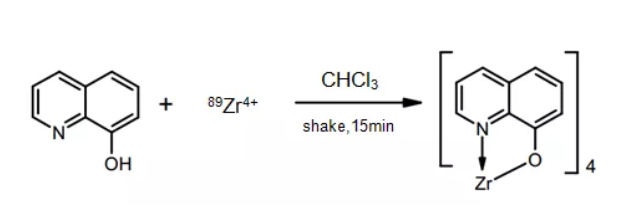
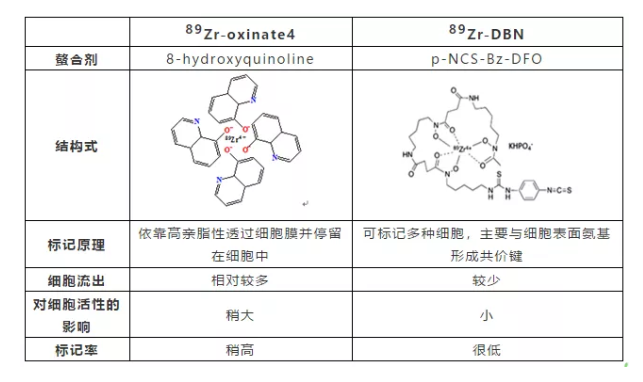
(1)89Zr-Oxinate法
用四个8-羟基喹啉与89Zr4+ 形成配位结构,然后通过89Zr-Oxinate高脂溶性特征被动扩散将89Zr-Oxinate扩散到细胞中,并留在细胞内。
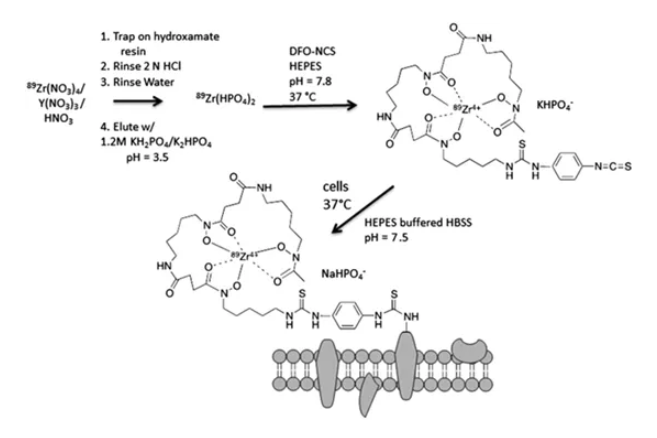
(2)89Zr-DBN法
通过2步合成,先将89Zr与p-NCS-Bz-DFO,89Zr记的p-NCS-Bz-DFO再与细胞膜表面蛋白氨基相结合,从而实现细胞的标记。如下图所示。
(2)两种标记方法比较
68Ga
介 绍
68Ga的半衰期为67.7min,衰变时89%的能量作为β+ 射线的形式释放,可用于PET显像。68Ga可直接从Ge68/Ga68发生器中淋洗出来,简便快捷。
直接标记
68Ga直接标记大分子仅限于某些特定蛋白质,如乳铁蛋白、转铁蛋白、铁蛋白等,或者直接标记具有螯合作用的小分子,如柠檬酸等。
间接标记
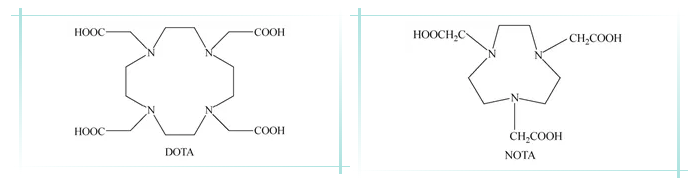
以双功能螯合剂作为桥梁,68Ga可以和生物活性物质形成稳定的标记物。常用于68Ga标记的双功能螯合剂为DOTA和NOTA。
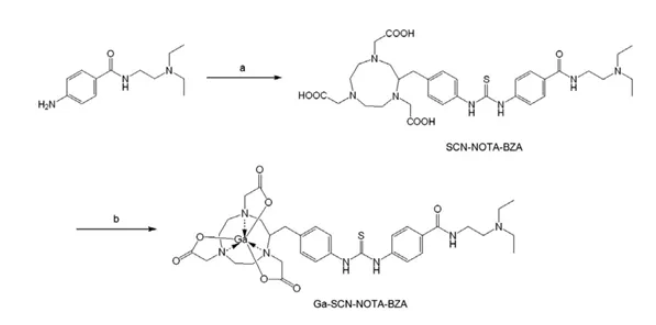
DOTA和NOTA游离的羧基在结合了生物活性物质后,可以与68Ga进行螯合,形成稳定的标记物,如下图所示。
59Fe
介 绍
59Fe的半衰期为44.5d,其能量主要以β和γ射线的形式释放,可用γ计数器检测59Fe,适用于含铁制剂的标记,如含Fe2O3/Fe3O4核磁造影剂,适用于含铁药物吸收,分布和物料平衡研究。
标记方法
通过工艺路线中将59FeCl3作为Fe原材料,经过工艺合成,可以得到含59Fe的标记产物,例如标记含Fe的纳米材料或含铁化合物。天然含Fe的生物活性物质如转铁蛋白、血红蛋白、固氮酶等,可以用59Fe置换普通Fe从而达到标记的目的。