日前,Molecular Oncology杂志发表了《欧洲离子治疗的现状》,介绍了离子治疗的基本概念以及欧洲国家质子治疗在临床中的应用、临床试验和临床研究的网络系统情况。

离子治疗的物理学和生物学优势
加速带电粒子在放射治疗中的应用最初由Robert R. Wilson在1946年提出。与常规X射线相比,离子治疗的物理优势在于其良好的深度-剂量分布,光子剂量随深度呈指数下降,高速离子最初沉积的能量很少,但其单位轨迹的能量损失随深度增加而增加,当它们接近组织范围时,能量达到最大值,称为布拉格峰(Bragg峰)(如图1所示)。因此,可以在不影响肿瘤照射剂量的情况下降低对危及器官的照射剂量。在光子放疗中,需要将多种不同角度的束流组合在一起,而离子束治疗只需要少量的束流即可。此外,与传统光子放疗相比,离子治疗还存在生物学上的优势,即Bragg峰附近带电粒子的高线性能量转移(LET):高密度电离模式诱导的聚集性DNA损伤,难以修复和触发不同的信号通路。
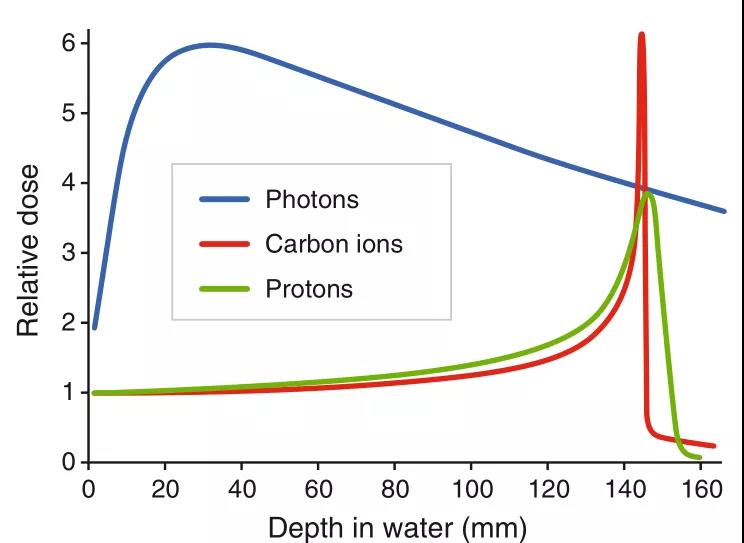
图1 离子治疗(质子和碳离子)与超高压X射线(光子)相比在物理和生物学上的优势
临床中的离子束递送技术
质子束治疗所需的能量范围约为60~250 MeV,覆盖穿透深度为数厘米(如眼部肿瘤)~25厘米以上(如盆腔肿瘤)。对于重离子,如碳离子,每个核子(MeV·u-1)各自的能量范围在120~430 MeV·u-1之间。欧洲多数专注于质子治疗的设施使用回旋加速器产生束流,而同时提供质子和碳离子治疗的四个欧洲离子治疗设施均基于同步加速器产生束流。回旋加速器在静态磁场下工作,因此离子束在磁场中的循环半径随离子束能量的增加而增大。当束流达到最大能量时,从回旋加速器中引出,并通过在束流中插入射程移位器被动减少束流的穿透深度。在同步加速器中,离子束在可变磁场强度下通过一个固定半径的环形轨道来补偿离子的能量。束流逐渐加速,可以以任何能量从环形轨道引出。如此可以主动选择束流的能量,而不是通过插入被动元件来降低束流的能量。
不管使用何种类型加速器,在束流引出后,狭窄的离子束流(笔形束)通过真空管道传输至治疗室。为了使离子束流形成不规则肿瘤的形状,临床上主要使用两种传输技术,即被动散射(passive scattering)和笔形束扫描技术(pencil beam scanning technique)。传统的被动散射技术中,通过散射束流的机械元件扩展笔形束,根据肿瘤的二维投影通过准直器来实现适形。通过被动元件实现Bragg峰的深度-剂量调制,以覆盖肿瘤的纵向范围。所有计划建设和最近建设的离子治疗设施,均应用或计划应用笔形束扫描技术,该技术束流在垂直和水平方向上受磁场影响而发生偏转。对于同步加速器,Bragg峰的深度位置通过主动能量变化来调整;对于回旋加速器,Bragg峰的深度位置通过射程移位器(range shifter)减少最大离子能量来调整。由于扫描技术不需要产生多余二级粒子(主要是中子)的机械元件来扩展束流和适形,因此其对健康组织的累积照射剂量较低。欧洲进行质子治疗(点扫描技术)的瑞士PSI研究所和进行碳离子治疗(光栅扫描技术)的德国达姆施塔特GSI研究所,开创了扫描束流递送的先河,为其在全球临床中的应用铺平了道路。
为了尽可能精确地检测、评估、描绘和追踪肿瘤体积,影像在离子治疗中起着至关重要的作用。不考虑束流递送技术,治疗计划通常基于多模态成像(CT、MR、PET)。笔形束扫描技术与计算机优化治疗计划相结合,根据预期治疗目的即靶区目标剂量和可接受的危及器官的暴露剂量计算出要传输的离子注量(particle fluence pattern)。传统的被动散射技术治疗计划在人工试验和误差优化中进行。
在图像引导光子束治疗的影响和推动下,先进的X射线成像(如锥形束CT, CBCT)在治疗室的集成才刚刚开始。室内成像可以说明治疗过程中随时间变化的解剖变化情况。此外,频繁和重复的成像是自适应放疗的前提,通过影像学方法检测到患者的特异性变化,以此进行治疗方案的修改。用离子治疗运动靶区具有挑战性,此治疗过程需要图像引导。像门控技术或肿瘤追踪这样的运动缓解技术中,同步加速器或回旋加速器产生束流的时间结构也非常重要。
临床经验
在1946年Robert R. Wilson报道仅6年后,John Lawrence和Cornelius A也进行了相关报道。来自伯克利放射实验室的Tobias首次将质子应用于临床,用340 MeV的质子束照射肢端肥大症患者的脑垂体。至此,已有超过19万例患者接受了质子治疗,2.8万例患者接受了碳离子治疗。目前,全球有80个已运营的质子治疗中心,其中约30%位于欧洲。欧洲质子治疗临床机构的数量正在快速增长:2017年有15个正在运营的治疗设施,到2020年底将会有31个质子治疗设施应用于临床(如图2所示)。目前亚洲有9家、欧洲有4家正在运营的碳离子治疗中心。
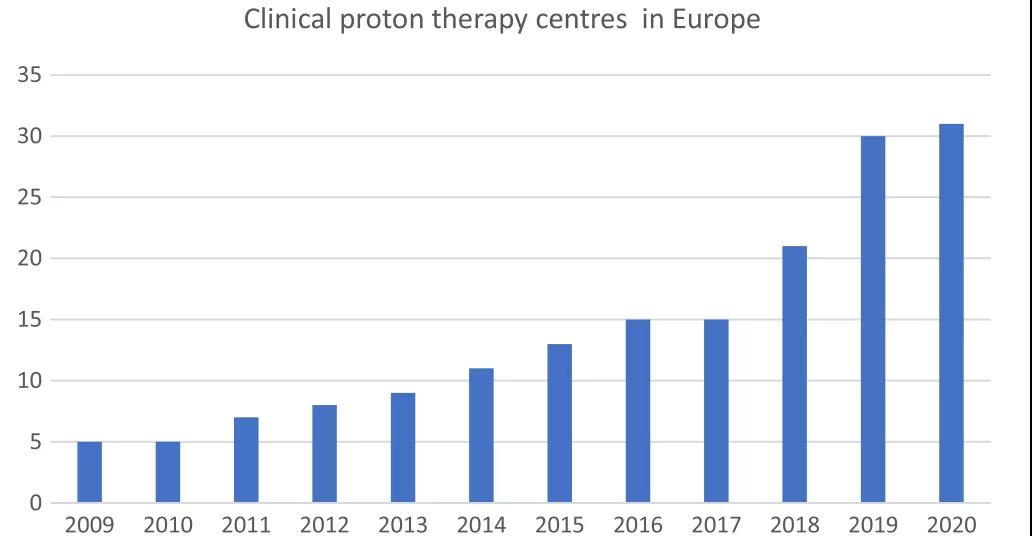
图2 2009-2020年欧洲临床质子治疗设施的数量
临床使用质子治疗的原理主要基于其有利的剂量分布。质子治疗可用于增加靶区的照射剂量,以提高肿瘤局部控制率,和/或通过降低肿瘤附近危及器官的照射剂量来降低放疗诱导的毒性反应(如图3所示)。颅底肿瘤(如脊索瘤或软骨肉瘤),是一种放疗抵抗的肿瘤,与光子放疗相比,质子治疗可将肿瘤控制率提高3~4倍。在儿童髓母细胞瘤中也观察到,与光子放疗相比,质子治疗可降低放疗诱导的毒性反应,即质子治疗可将患者体内靶区以外的照射剂量降低4.5~6倍,从而降低放疗诱导继发性恶性肿瘤的风险。
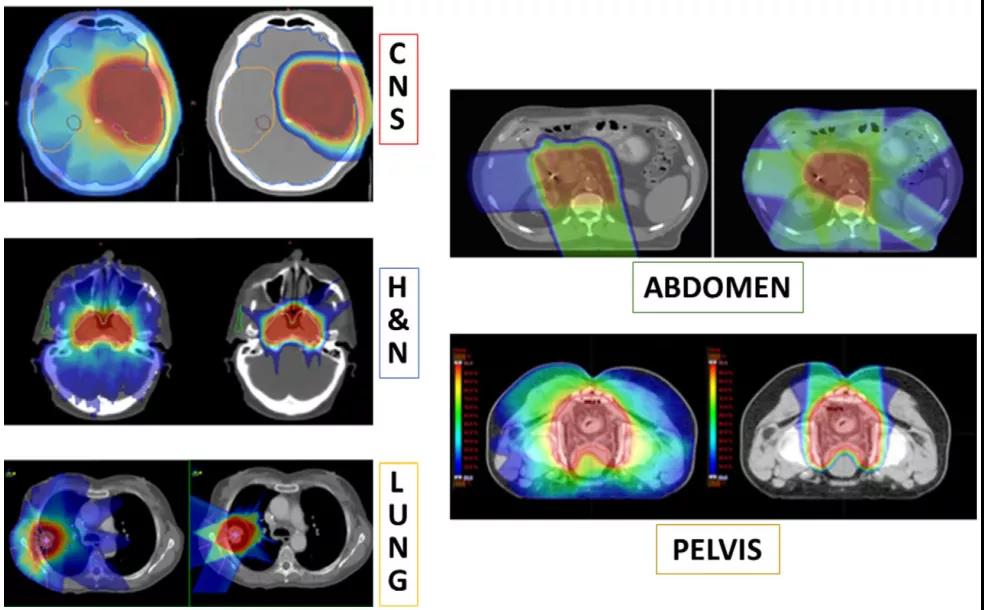
图3 不同肿瘤部位的X射线(左)和质子(右)治疗方案的比较
当前适应证
目前,质子治疗仅在有限的几种癌症类型中被认为是标准治疗,质子治疗的核心适应证如表1所示,其核心适应证可能因国家而异。大多数欧洲国家接受质子治疗作为儿科的适应证。对于其他的适应证,一些国家根据限制清单来对质子治疗进行报销(如法国、意大利、波兰、瑞士)。其他国家(如瑞典、丹麦、捷克)没有固定批准的适应证类型,在这些国家,质子治疗基于多学科肿瘤委员会的决定来管理。荷兰将基于模型的方法应用于选定新的适应证。在许多国家,包括德国和美国,均可提供质子治疗,前提是病人的医疗保险可以报销质子治疗费用。在美国,有相当数量的病人拒绝接受质子治疗。