在过去的5~10年间,多模式成像已成为药物发现与开发研究人员分析工具箱的重要组成部分。但目前在临床前阶段使用的技术自有其渊源,并已在早期临床研究和常规人体诊断中得到验证。
在这里,我们将重点介绍这些成像方式中或许是最常用,且应当是最灵敏、最定量化的一种,它被称为PET/CT,即正电子发射断层扫描(PET)与X射线计算机断层扫描(CT)的结合。简单地说,PET被用于人体内分子过程的可视化:系统检测由正电子放射配体间接发射的伽马射线对,该配体则通过生物活性放射性示踪剂引入人体。CT扫描从不同角度对扫描物体进行的大量X射线测量,并用计算机对这些结果进行处理,生成被扫描物体特定区域的横截面图像,用户可以在不切割物体的情况下看到物体内部。
由此产生的配准后图像提供了必要的知识,有助于跨越临床前与临床的界限,从此点上看,临床前证据足以表明是否将某个候选新药推升到首次人体临床研究阶段。
影像学简史
影像学的早期发展主要集中在人体的临床应用上。20世纪50年代,物理学家Gordon Brownell和神经外科医生William Sweet创建了一套用于检测脑肿瘤的系统。大约20年后,Edward Hoffman、Michael M. Ter-Pogossian和Michael E. Phelps于1973年在华盛顿大学建造了第一台用于人体研究的PET相机。Phelps通常被认为是PET发明者,并因其贡献而荣获了1998年恩里科•费米总统奖。一批重要的技术发展,包括放射性示踪剂、探测器和仪器几何结构方面的显著改进,催生了一系列更为完善的仪器,这些早期的发展已得到了广泛的探讨。1
2000年,David Townsend和Ronald Nutt的PET/CT扫描仪被《时代》杂志评为年度医学发明。
在这种背景下,药物研究人员很快就意识到,成像技术可以应用于药物开发。它们有可能提高人们对疾病的认识,并为选择最有可能成功的候选药物或停止开发最终可能失败的药物提供更好的决策依据。
理论与实践
PET通常通过静脉注射(iv)放射性示踪剂(与放射性同位素结合的分子)创建受试者的三维(3D)图像。载体分子可以与体内特定的蛋白质、受体和生物分子途径结合,以量化特定的生物活性。放射性同位素,通常是氟-18(18F)或碳-11(11C),产生与周围电子相互作用的正电子,导致两个粒子的湮灭和两个光子(伽马射线)的释放。这些光子以相反的方向(约180°)发射,并由PET扫描仪中的探测器拾取,以绘制体内放射性核素的分布图。
成功的药物开发依赖于理解动态生物学过程、基因表达、酶和蛋白质活性、疾病的进展与治疗、生物分布以及新药的药代动力学/药效学的能力。PET/CT的多模式成像法提供了一种手段,既可以绘制药物随时间推移在全身的路径图,也可以监测疗效并确定其是否适合临床应用。选择最适合在药物开发范围内使用的成像方法,应基于将该技术应用于解决临床领域类似问题这一思路。
相关技术考虑包括造影剂的灵敏性、空间分辨率、时间分辨率、靶点特异性和生物分布。重要问题之一是确保信号反映的是组织表型,而非主要反映血流、血管通透性或其它可能影响示踪剂摄取的变量。实际考虑还包括成本、可用性和安全性。
强大的肿瘤学数据
临床前研究人员有兴趣了解肿瘤发展的生物学、对癌症治疗的反应以及药物毒性。PET/CT等成像技术可以揭示不同肿瘤类型的进展机制,以及治疗对它们产生的影响。
许多癌症与比正常细胞更高的代谢转换有关,因此,使用PET和注射的放射性标记葡萄糖类似物示踪剂,如18F-脱氧葡萄糖(18F-FDG),可以量化葡萄糖摄取,并检测肿瘤负荷。该方法还可用于识别分子生物标记物,为癌症检测和治疗反应评估做出贡献。PET/CT用于确定18F-FDG的聚集区,获得半定量标准摄取值(SUV),有助于对肿瘤性质的诊断。血流是另一项重要标志,肿瘤血管化有可能区分非肿瘤性和肿瘤性病变。
癌症常常是联合药物疗法的靶标。这些方案可以处理多个分子靶点,并减少产生耐药性的机会。在一项研究中,研究人员使用临床前PET/CT成像监测不同疗法组合的18F-FDG肿瘤摄取:单独放疗(Rad)、Rad加替莫唑胺(Tmz)、Rad加米非司酮(Mife),以及Rad加Mife加Tmz。2 所有数据都是在三模式小动物PET/SPECT/CT系统上使用多动物传输系统(多动物传输系统——MATS,和Bruker Albira II,Bruker Biospin GmbH)采集的。
Rad加Tmz是胶质母细胞瘤的典型治疗方案,但研究发现,使用Mife作为启动剂比其它疗法组合更能抑制肿瘤生长(图1)。Mife的这种化学放射增敏作用的机制尚未能完全阐明,但这类研究有助于研究人员朝着改进现有癌症疗法的方向迈出重要的一步。
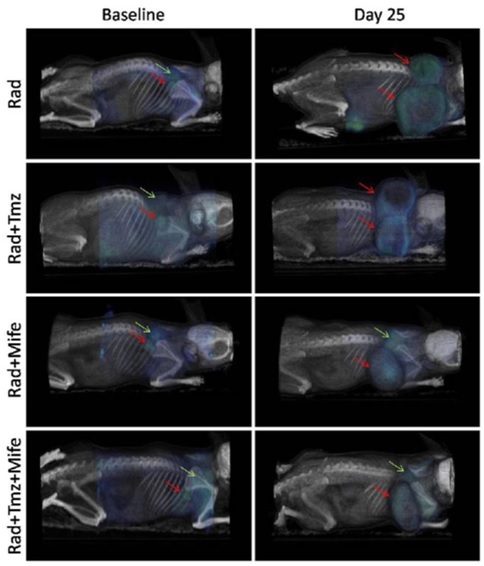
图1:PET/CT图像显示在治疗起始日和25天后,四种疗法组合中18F-FDG的肿瘤摄取。红色箭头表示起始日和第25天的肿瘤位置,绿色箭头表示棕色脂肪组织(BAT)中典型的18F-FDG摄取位置。依据知识共享协议许可(https://creativecommons.org/licenses/by/2.0/)从参考文献[2]中复制。
总结
PET/CT成像的发展使生理学、药理学和生物化学检测在临床前药物开发各阶段中的价值得到持续提升。我们对目标疾病的基本认识已经更加深入,疾病发展和疗效的重要标志正在被揭示出来并可被监测。现代先进仪器的核分子成像能力使药物研究人员能够通过临床前研究来开发潜在的药物,从而更快、更有效地开发未来的治疗方法。
有关Bruker临床前成像解决方案的更多信息,请访问:https://www.bruker.com/products/preclinical-imaging/nuclear-molecular-imaging.html
参考文献
1. Jones T and Townsend D (2017) History and future technical innovation in positron emission tomography. J Med Imaging (Bellingham). 4(1):011013. doi:10.1117/1.JMI.4.1.011013.
2. Llaguno-Munive M, Medina LA, Jurado R, Romero-Piña M, Garcia-Lopez P (2013) Mifepristone improves chemo-radiation response in glioblastoma xenografts. Cancer Cell International. 13:29. https://doi.org/10.1186/1475-2867-13-29.
关于作者
Todd Sasser博士是Bruker临床前成像应用负责人。他直接与各研究点合作,涉及感染成像、癌症生物学和探针开发等多个学科领域的PET应用。Sasser博士曾就读于利物浦大学和夏威夷大学,还是圣母大学的访问学者。
关于Bruker公司
50多年来,Bruker已帮助科研人员取得可提高人类生活品质的突破性发现,并开发出诸多新的应用。Bruker的高性能科研仪器和宝贵的分析解决方案,使科研人员得以在分子、细胞和微观水平上开展对生命和材料的探索。
通过与客户的密切合作,Bruker致力于帮助实现创新、生产力提升以及客户成功,领域涉及生命科学分子研究、制药应用、显微镜、纳米级分析、工业应用,以及细胞生物学、临床成像、临床研究、微生物学和分子诊断。