放射医学与辐射防护国家重点实验室、放射医学与防护学院史海斌教授课题组通过发展肿瘤微环境激活型核糖核酸酶靶向嵌合体用于肺癌精准高效放射治疗取得新进展,相关成果以“Stimulus-activated ribonuclease targeting chimeras for tumor microenvironment activated cancer therapy”为题于2月3日在线发表在国际知名期刊Nature Communications上。论文链接:https://doi.org/10.1038/s41467-025-56691-3。
传统的RNAi疗法中,反义寡核苷酸和小干扰RNA(siRNA)常被用来沉默目标RNA。然而其临床前景受到多方面问题的严重阻碍,例如细胞摄取率低、递送效率差、潜在的生物毒性以及RNA易被核糖核酸酶(RNases)降解等。因此开发一种能够高效降解目标RNA且低毒的技术,对于实现癌症的精准高效治疗意义重大。
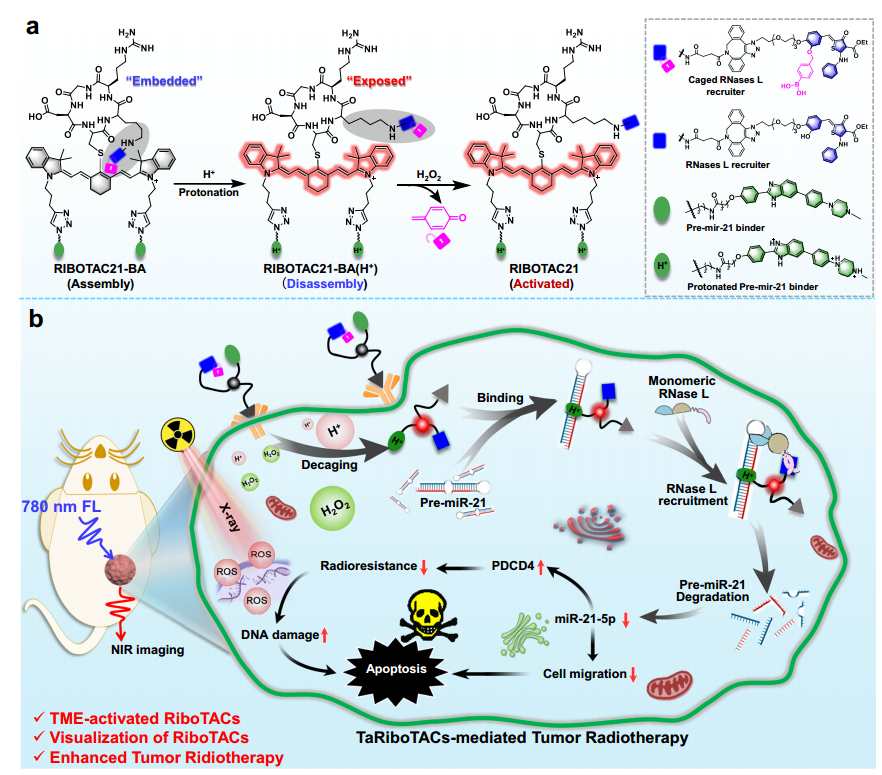
图. 肿瘤微酸性和H2O2双激活的核糖核酸酶靶向嵌合体用于pre-miR-21降解及肺癌放疗增敏
为了克服传统肿瘤RNA干扰技术存在的上述弊端,史海斌课题组通过发展智能光控的肿瘤RNA共价化学修饰策略在肿瘤诊疗方面开展了大量研究(Angew. Chem. Int. Ed. 2023, 62, e202218969; CCS Chemistry, 2023, 6, 999; J. Am. Chem. Soc. 2022, 144, 23061; Angew. Chem. Int. Ed., 2021, 60, 23805;J. Am. Chem. Soc. 2020, 142, 21502)。基于上述研究基础,在最新研究进展中,创新性发展了一种肿瘤微环境激活的核糖核酸酶靶向嵌合体(TaRiboTACs),该技术通过精准高效降解肺癌细胞中的pre-miR-21分子,有效抑制肿瘤细胞生长,同时大幅提高了肺癌细胞的放射治疗敏感性。该TaRiboTACs探针分子由两个pre-miR-21结合剂、一个近红外荧光染料IR780、一个肿瘤靶向环肽cRGD和一个苯硼酸笼屏蔽的核糖核酸酶招募剂构成。在肿瘤微环境的酸性pH和高H2O2水平下,TaRiboTACs的核糖核酸酶招募功能在肿瘤病灶被特异性激活,实现了肺癌细胞中pre-miR-21的精准高效降解,同时降低了对正常组织的毒副作用,提高了治疗的安全性和有效性。该研究不仅发展了一种新型的RNA降解技术,还为恶性肿瘤的精准高效治疗提供了新手段。
苏州大学苏州医学院放射医学与防护学院2022级博士研究生张誉荠为该论文第一作者,国重室史海斌教授为通讯作者。该研究得到了国家自然科学基金杰青、面上、江苏省基础研究计划及放射医学与辐射防护国家重点实验室开放课题等资助。