《Acta Neurochir urgica(Wien)》杂志 2024 年12月6日在线发表瑞典Karolinska University Hospital的Felicia Lindberg , Alexander Gabri , Helena Kristiansson , 等撰写的《重复伽玛刀放射外科治疗生长中的垂体腺瘤后的长期肿瘤控制:基于人群的队列研究。Long-term tumor control following repeat gamma-knife radiosurgery of growing pituitary adenomas: a population-based cohort study》(doi: 10.1007/s00701-024-06341-2.)。

背景:
伽玛刀放射外科(GKRS)是部分切除后残留或生长的垂体腺瘤(PAs)的一种公认的治疗方法。然而,一些PAs即使在初始GKRS治疗后也会生长,因此尚不清楚重复GKRS的疗效。本研究的主要目的是确定PA患者重复GKRS治疗后的长期无进展生存期(PFS)。次要目的是确定这些患者肿瘤进展的预测因素。
垂体腺瘤(PAs)是良性的,通常生长缓慢,约占所有原发性颅内肿瘤的10 - 15%。他们可能出现内分泌和/或神经系统症状,治疗方案包括手术、激素分泌亢进的药物治疗、观察等待、伽玛刀放射外科(GKRS)和分次放疗(FRT)。与FRT相比,GKRS由于其精度高,对周围敏感结构的侧向辐射少,有更快速的效果,通常作为首选。
重复GKRS对初始GKRS后生长的PAs的有效性仅在少数少量患者样本的研究中得到证实。Alonso等研究了21例因分泌生长激素(GH)PAs而接受重复GKRS的患者,结果表明,中位随访3.4年后,15例患者(83%)的肿瘤得到控制;然而,重复GKRS的适应证是激素活性而不是肿瘤生长。Clin等观察了12例无功能PAs患者,中位时间为7.1年,重复GKRS治疗后发现33%的患者肿瘤生长。Jagannathan等对库欣病患者的研究表明,10名复发患者中有7名接受了重复GKRS治疗,其中3名获得了第二次缓解;然而,指征是库欣病复发,测量的结果是缓解而不是肿瘤控制。同样,Mehta等报道了库欣病患者接受反复立体定向放射外科的5年缓解率为47%,但没有提供肿瘤控制的数据。此外,一篇关于难治性PAs放疗的文献综述表明,在特定病例中,多个疗程的放疗可以成功地控制肿瘤。Verma等报道5年PFS率为58%;然而,最初的治疗并不是专门的GKRS,只有两名患者接受了GKRS作为第二次治疗,而其他患者接受了不同形式的放疗。Minniti等对分次立体定向放疗第二疗程的研究显示,4年肿瘤控制率为65%;然而,这项研究包括PAs和垂体癌,并联合立体定向放射外科与替莫唑胺[19]。Verma 等和Minniti 等均认为,立体定向放射外科的反复治疗可能会对生长中的PAs患者产生有利的结果,但第二次GKRS治疗后的肿瘤控制数据仍然非常有限。考虑到上述知识差距,本研究的主要目的是评估初始GKRS治疗后出现生长的PAs患者重复GKRS治疗后的PFS。次要目的是确定这些患者肿瘤进展的可能预测因素。
方法:
对瑞典斯德哥尔摩卡罗林斯卡大学医院神经外科1999年至2022年间因肿瘤进展而接受重复GKRS治疗的复发性PAs患者进行单中心、基于人群的连续队列研究。评估PFS和肿瘤生长预测因子。
研究设计和患者选择
这是一项回顾性的、基于人群的连续队列研究,包括1999 - 2022年在瑞典斯德哥尔摩卡罗林斯卡大学医院神经外科接受GKRS治疗的复发性PA的成年患者。在重复GKRS之前,所有患者都接受了经颅或经蝶窦手术切除和初始主要性GKRS。患者从Leksell Gammaplan®(Elekta Instruments Inc.)数据库中识别,所有接受GKRS治疗的患者均在该数据库中注册并保存治疗信息。不居住在斯德哥尔摩地区的患者以及随访数据不充分或无法获得的患者被排除在外。使用健康记录软件TakeCare®(CompuGroup Medical Sweden AB, Farsta, Sweden)收集患者和影像数据。使用Leksell Gammaplan®10.1.1 (Elekta Instruments Inc.)收集GKRS信息和辐射数据。该研究得到了瑞典伦理审查局(Dnr: 2017/1760-31/1)的批准,该机构放弃对知情同意的需要。
统计分析
为了确定连续变量的数据分布,使用了Shapiro-Wilk检验。对于非正态分布的数据,数据以中位数(四分位数范围)表示,对于正态分布的数据,数据以均值±标准差表示。分类数据以数字(比例)表示。主要终点是肿瘤进展,定义为重复GKRS后肿瘤大小的增加。与之前的检查相比,肿瘤的生长是通过MRI上可测量的大小增加来确定的,由两位经验丰富的神经放射影像学家独立评估。为了确定肿瘤进展的预测因素,以肿瘤进展为因变量,可能的危险因素为解释变量,进行逻辑回归。为了确定5年PFS,我们建立了Kaplan Meier图。所有分析均使用统计软件R (R版本4.1.2)进行。p<0.05为差异有统计学意义。
伽玛刀治疗和随访
重复GKRS的指征是MRI证实的PA肿瘤生长。在肿瘤生长的病例中,患者在多学科会议上讨论,放射肿瘤学家、神经外科医生、神经放射学家和内分泌学家出席,讨论额外的治疗方法。肿瘤再生长或进展的治疗选择包括第二次手术或重复GKRS治疗。GKRS在门诊进行。在注射局麻药后,用四颗螺钉将立体定向框架固定在患者的颅骨上。框架固定后,进行立体定向MRI以描绘靶标和邻近结构。根据MRI结果制定治疗方案并行GKRS。治疗后,患者在神经外科病房留院观察数小时后出院。随访包括GKRS后1、2、5、8和10年的MRI,以发现潜在的肿瘤生长,个体差异由多学科肿瘤委员会确定。
结果:
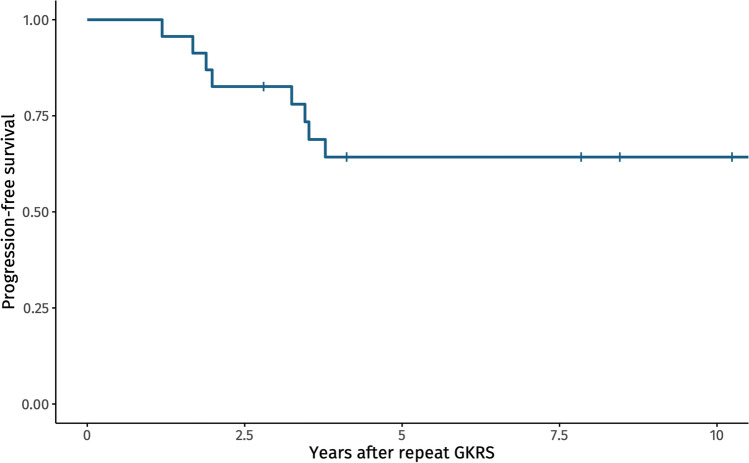
纳入23例患者,中位随访时间6.3年。5年PFS率为57%,从重复GKRS治疗到肿瘤进展的中位持续时间为2.6年。重复GKRS治疗后的肿瘤生长仅发生在治疗后的前三年。重复GKRS治疗时年龄较大是肿瘤持续生长的重要预测因子(OR 1.09, p = 0.036)。
共有334例PAs患者接受手术切除和GKRS治疗。其中31例因肿瘤生长而接受重复GKRS治疗。8/31例患者因居住在医院转诊区域以外(n=7)或无法获得随访资料(n=1)而被排除。因此,研究纳入了23例患者(图1)。

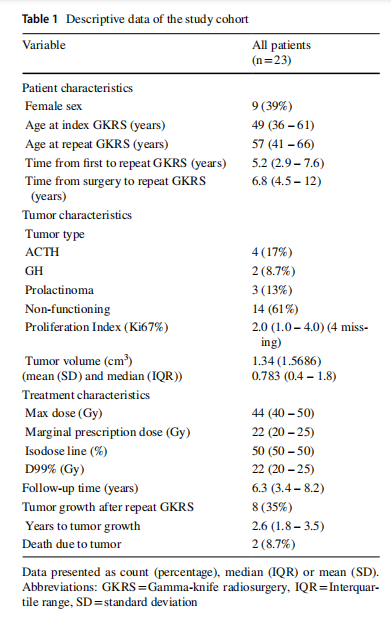
该队列首次GKRS时的中位年龄为49岁,再次GKRS治疗时的中位年龄为57岁,其中39%为女性。从手术到再次GKRS的中位时间为6.8年,而从首次到再次GKRS的中位时间为5.2年。61%的PAs为NFPA, 17%为acth生成瘤,8.7%为GH生长激素瘤,13%为泌乳素瘤。初始活检后的中位增殖指数(Ki67)为2%(表1)。
重复GKRS治疗后的中位随访时间为6.3年。在此期间,8例(35%)出现肿瘤生长,中位生长时间为2.6年。2例患者死于垂体腺瘤:1例死于不典型ACTH产生腺瘤的转移性神经内分泌肿瘤(NET), Ki-67指数从2%上升到30%以上;另1例死于与垂体泌乳素NET相关的肿瘤负荷,Ki-67指数为4%。两例均被归类为不典型垂体腺瘤(表1)。
在预测重复GKRS后肿瘤生长的logistic回归分析中,观察到年龄较大与肿瘤生长有显著相关性(OR = 1.09, p = 0.036)。未发现其他显著的肿瘤生长预测因子(表2)。

讨论:
本研究的目的是评估在初始GKRS治疗后进展的PAs患者重复GKRS后的PFS。我们确定5年PFS为57%,重复GKRS治疗的年龄越大,进展风险增加。
在我们的研究中,35%的患者在重复GKRS后出现肿瘤进展,这与文献报道的33%的进展率相似。Clin等报道了12例患者,中位随访时间为7.1年,略长于我们的6.3年。
我们的研究和Clin等人在复发率上的相似性表明,观察到的复发率近似于实际的进展风险。图2加强了这一推断,说明如果肿瘤发生进展,则仅在重复GKRS后的头三年内发生。在另一项由Alonso等人进行的关于分泌生长激素腺瘤中重复GKRS的研究中,进展率较低(16.7%)。然而,Alonso等人并没有认为肿瘤生长是重复GKRS的唯一适应证,因此关于肿瘤控制的结果是不可比较的。与初始主要性GKRS的肿瘤控制数据相比,我们的研究中肿瘤控制率较低],这突出了需要重复GKRS的PAs的不同生物学特性。
在我们的队列中,年龄是肿瘤进展的重要预测因子(OR 1.09)。虽然没有研究报道重复GKRS环境下肿瘤生长的预测因子,但先前关于初始主要性GKRS治疗的文献并未将年龄确定为预测因子;相反,肿瘤体积被强调为肿瘤生长的预测因子。高龄作为肿瘤生长的预测因子,可能受到不同垂体腺瘤类型往往发生在不同年龄这一事实的影响,这可能使肿瘤类型成为一个混杂因素。然而,在我们的分析中,激素分泌(用作肿瘤类型的代理)并未被确定为肿瘤再生的重要预测因子。这表明在我们的队列中,年龄仍然是一个独立的因素,而不是肿瘤类型来解释观察到的关联。老年患者的生物恢复能力也可能降低,包括放疗后细胞修复能力下降,还可能有较高的合并症负荷,这可能影响治疗耐受性和有效性。既往手术或放疗的累积效应也可能影响组织对重复GKRS的反应。此外,老年患者的肿瘤在重复GKRS治疗时可能更具进袭性,特别是如果他们已经复发或随着时间的推移而进展。这些因素可能共同解释了在老年患者中观察到的肿瘤再生长的风险增加。
关于肿瘤体积的差异通常被视为肿瘤生长的预测因子(尽管在我们的研究中并非如此)-至少可以部分解释为不同文献中“大体积”的不同定义;先前的研究将大于5 cm3的肿瘤分类为大肿瘤。我们的中位肿瘤体积明显小于0.84 cm3,少数患者(n=3)的肿瘤体积大于5 cm3,这可能是观察到的结果差异的原因。此外,在我们的方案中,频繁使用MRI扫描来早期检测肿瘤复发可能已经阻止了大肿瘤的发展。因此,在我们的研究背景下,肿瘤体积并没有成为重复GKRS治疗后进展的重要预测因素。另一项研究证实,小于1 cm3的肿瘤和不侵犯海绵窦的肿瘤对原发性GKRS有良好的反应,尽管这些结果不太适用于重复GKRS的情况,因为它们是特异性的初始治疗结果。
增殖指数在文献中经常被引用作为一个重要的预后因素。在我们的分析中,单变量逻辑回归显示OR为1.52,增殖指数Ki67的p值为0.101,由于缺乏定义的截断值,因此被视为连续变量。
值得注意的是,较小的样本量往往会导致统计能力降低,从而导致p值升高。在我们的23例患者队列中,19例患者的增殖指数被记录下来,因为没有进行Ki67测量或有4例患者的数据不可用。鉴于我们的结果接近统计学意义,结合增殖指数与肿瘤生长的生物学原理,进一步研究增殖指数作为预后因素是有必要的。
优势与局限
这项研究得益于斯德哥尔摩的人口为基础,包含了一个全面的连续数据集,缺失数据最少。该研究的单中心性质确保了治疗方案和程序的一致性,增强了整个研究期间的一致性,并最大限度地减少了与治疗和随访实践相关的内部偏差。然而,必须承认,我们的研究组是一个经过高度选择和异质性的队列,由接受过多种先前治疗的患者组成,表明具有挑战性的肿瘤管理。该研究的选择性以及这些患者被认为适合重复GKRS的事实可能会影响研究结果的普遍性。此外,我们研究的回顾性和缺乏肿瘤再生长的标准化体积切割应该被考虑在内。在我们的队列中,重新治疗的决定是基于个体化的临床评估,考虑MRI结果和患者症状。虽然这反映了现实世界的临床实践,但与使用硬性体积阈值的研究相比,它可能会限制可重复性。如果及时干预阻止肿瘤进展,采用严格的回顾性切口可能无法捕获病例,这突出了平衡标准化标准与个性化护理的挑战。最后,有限的参与者数量反映了这一患者群体的稀缺性,强调了多中心研究的必要性——最好是利用前瞻性登记——来证实和扩展我们的发现。尽管存在这些限制,我们相信我们的研究对于重复GKRS在复发性PAs管理中的有效性提供了有价值的知识。
结论:
对于初始GKRS治疗后出现生长的PAs,重复GKRS治疗是一种可行的治疗选择。
本研究表明,对于生长中的PAs,重复GKRS治疗后的5年PFS率为57%,年龄越大,肿瘤进展的风险越高。重复GKRS治疗后的肿瘤生长仅发生在治疗后的前三年。虽然基于一个小的,选定的队列,但这些发现为影响重复GKRS治疗生长PAs的疗效的结果和因素提供了有价值的见解。