已知电离辐射可诱导肿瘤细胞的免疫原性细胞死亡,随后将抗肿瘤免疫细胞动员到受照射部位,这一关键过程为这些免疫细胞向远处肿瘤扩散铺平了道路,从而在控制转移中发挥了重要作用。与XRT的出口辐射剂量相比,PRT独特的Bragg峰特性允许更精确地将辐射能量沉积到肿瘤中。这种精确性为激发抗肿瘤免疫反应提供了一个更有利的平台。通过减少对周围淋巴结的附带损伤和减少辐射引起的淋巴细胞减少,PRT可能对血液中免疫细胞的保存有重要贡献。
尽管有这些优势,但现有的科学文献中对质子IRT和光子IRT疗效的比较研究明显不足。鉴于IRT临床应用的增加和质子治疗中心的全球增长,理解质子IRT和光子IRT的治疗区别和基本机制至关重要。

近日,来自美国德克萨斯大学的研究者们在J Nanobiotechnology杂志上发表了题为“Superior antitumor immune response achieved with proton over photon immunoradiotherapy is amplified by the nanoradioenhancer NBTXR3”的文章,该研究揭示了质子比光子免疫放疗获得了优越的抗肿瘤免疫应答,可能扩大NBTXR3的治疗应用范围。
最近的研究结果表明,免疫放射治疗,结合光子放射治疗或质子放射治疗(PRT)与免疫检查点阻断,可以增强全身肿瘤控制。然而,XRT和PRT在IRT中的比较疗效仍有待研究。
为了解决这个问题,研究者比较了XRT + αPD1和PRT + αPD1在小鼠αPD1耐药肺癌(344SQR)中的结果。研究者还评估了纳米颗粒半径增强剂NBTXR3对XRT + αPD1和PRT + αPD1肿瘤控制的影响,并使用单细胞RNA测序(scRNAseq)检测肿瘤免疫微环境。此外,用NBTXR3 + PRT + αPD1治疗的小鼠再攻三种肺癌细胞系,以评估记忆抗肿瘤免疫。
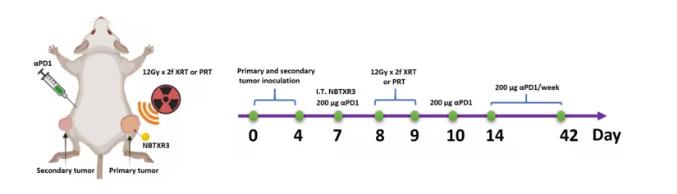
NBTXR3、XRT、PRT和αPD1联合治疗方案在αPD1耐药肺癌小鼠模型中的描述
研究结果表明:与XRT + αPD1相比,PRT + αPD1具有更好的局部肿瘤控制和体外效果。NBTXR3 + PRT + αPD1对肿瘤的控制效果明显优于NBTXR3 + XRT + αPD1,可促进抗肿瘤淋巴细胞更大程度地浸润辐照肿瘤。与NBTXR3 + XRT + αPD1治疗组相比,NBTXR3 + PRT + αPD1治疗组肿瘤的NKT细胞、CD4 T细胞和B细胞数量增加,treg细胞数量减少。与NBTXR3 + XRT + αPD1相比,NBTXR3 + PRT + αPD1还能刺激淋巴细胞中IFN - γ、GzmB、Nkg7的表达升高,TGF - β通路降低,肿瘤坏死因子α表达升高。此外,NBTXR3 + PRT + αPD1在放疗和未放疗肿瘤中均导致M1巨噬细胞更大的极化。
通过NBTXR3 + PRT + αPD1获得缓解的小鼠表现出强大的记忆免疫反应,有效抑制了来自三种不同肺癌细胞系的后续肿瘤的生长。质子IRT联合NBTXR3在治疗αPD1耐药肺癌方面比基于光子的治疗提供了更好的肿瘤控制和生存率,表明其作为一种有效的全身治疗的潜力。
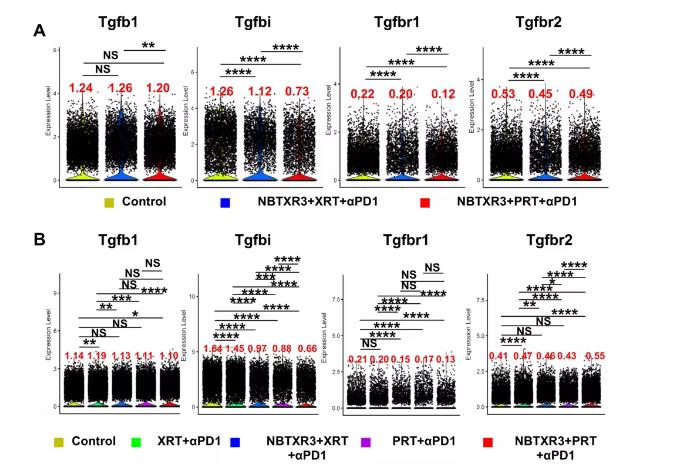
与NBTXR3 + XRT + αPD1相比,NBTXR3 + PRT + αPD1减少TGF - β通路基因的表达
综上所述,本研究结果强调了与光子放射治疗相比,基于质子放疗的免疫放射治疗可以增强肿瘤控制和延长生存期,这种优势的基础是更有效的局部和全身抗肿瘤免疫反应。重要的是,NBTXR3与PRT + αPD1或XRT + αPD1联合使用的协同效应大大增强了两种方式的治疗效果,增强的疗效与增强的抗肿瘤免疫反应有关。这些结果为XRT和基于prt的IRT的临床转化提供了有价值的见解,有可能扩大NBTXR3的治疗应用范围,超出其目前的适应症。