• 在研究64Cu/67Cu SAR-bisPSMA治疗转移性去势抵抗性前列腺癌(mCRPC)的诊疗SECuRE试验中,队列3的第1名参与者已经接受了最高剂量水平12GBq的治疗。
• 队列2近期有3名参与者接受了8GBq剂量水平的67Cu SAR-bisPSMA治疗。
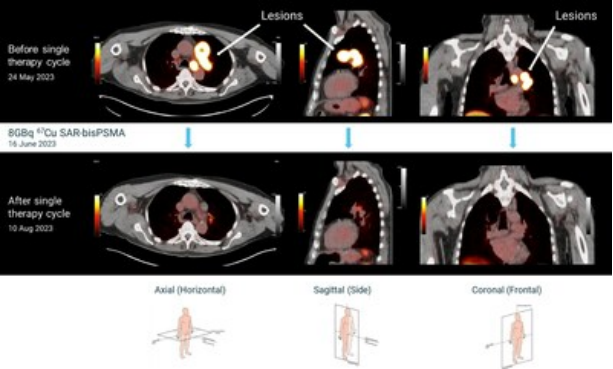
• 队列2的数据表明,8GBq剂量的67Cu SAR-bisPSMA对所有参与者产生了积极影响,在单剂给药后的几周内,所有参与者的前列腺特异性抗原(PSA)水平降低超过50%。
• 迄今为止,在任何试验参与者中均未报告剂量限制毒性(DLTs)。
• 美国临床中心正在进行队列3的招募工作,队列3的剂量水平为12GBq的67Cu SAR-bisPSMA,这是剂量递增阶段的最高剂量水平。
Clarity Pharmaceuticals是一家临床阶段的放射性制药公司,其使命是开发下一代产品,改善儿童和成人癌症患者的治疗结果。该公司高兴地宣布,在评估67Cu SAR-bisPSMA治疗转移性去势抵抗性前列腺癌(mCRPC)参与者的I/II期治疗试验的第3队列中,第1名参与者的剂量达到最高剂量水平12GBq。
SECuRE试验(NCT04868604)[1]是一项I/IIa期诊疗试验,使用64Cu/67Cu SAR-bisPSMA识别并治疗表达前列腺特异性膜抗原(PSMA)的mCRPC参与者。64Cu SAR-bisPSMA用于观察表达PSMA的病变,并为随后的67Cu SAR-bisPSMA治疗选择候选患者。该试验是一项多中心、单组、剂量递增的试验,在美国参与试验的队列已扩展到多达44名参与者。这项试验的总体目标是确定67Cu SAR-bisPSMA治疗前列腺癌的安全性和有效性。
队列3探讨了对SECuRE试验参与者,单次给药最大剂量12GBq 67Cu SAR-bisPSMA的影响。第3个队列将是最后一个评估67Cu SAR-bisPSMA单次剂量的队列,随后将进行多剂量队列,并等待安全性评估。
该试验剂量递增阶段的前2个队列均已成功完成,接受剂量的任何参与者均未报告DLTs。队列2中的3名参与者接受了单剂8GBq的 67Cu SAR-bisPSMA治疗,其医师按照试验方案监测了安全性和治疗应答情况。队列2的全部3名参与者在接受8GBq 67Cu SAR-bisPSMA给药后仍留在试验中,所有3例参与者的PSA降幅均超过50%,这是SECuRE试验的主要终点之一,也是该患者人群中疗效的常用替代终点。所有患者的PSA水平继续下降,前2名参与者的降幅超过95%,最后1名参与者到目前为止的降幅约为70%。
Clarity的执行主席Alan Taylor博士评论说:“队列2的结果令人非常兴奋,我们期待看到来自增加12GBq剂量的数据,以及发现多剂量给药对前列腺癌患者的潜在积极影响。
“该试验进入剂量增加阶段的快速招募表明,前列腺癌治疗领域有大量未满足的需求,我们很高兴能够致力于该解决方案,不仅有可能为mCRPC患者提供治疗益处,而且还能解决当前放射性药物(如177Lu PSMA-617)在物流和制造方面的挑战。特别是现在,美国国内常规生产的67Cu放射性同位素的商业数量可用性也得到了满足,由NorthStar独家供应。
Taylor博士说:“随着我们继续招募参与者进入SECuRE试验,并在商业化道路上取得进展,我们期待分享更多关于67Cu SAR-bisPSMA的数据,最终目标是改善癌症患者的治疗结果。”
关于SAR-bisPSMA
SAR- bispsma的名字来源于“bis”一词,这反映了一种将两种PSMA靶向剂与Clarity专有的sarcophagine (SAR)技术连接起来的新方法。该技术可以安全地将铜同位素固定在一个名为螯合剂的笼状结构中。与其他市售的螯合剂不同,SAR技术可以防止铜渗漏到体内。SAR-bisPSMA是一种靶向铜的诊断治疗剂(TCT),可与Cu-64一起用于成像,与Cu-67一起用于治疗。
64Cu SAR-bisPSMA和67Cu SAR-bisPSMA作为尚未获得注册的产品。单个结果可能不代表产品的整体安全性和有效性。本公告中概述的数据尚未经过美国食品和药物监督管理局(FDA)等卫生当局的评估。目前公司正在进行一项临床开发计划,以评估这些产品的有效性和安全性。不能保证这些产品将成为商业可用。
关于前列腺癌
前列腺癌是全球男性中诊断出的第二大常见癌症,也是全球癌症死亡的第五大原因。美国癌症研究所估计,到2023年,美国将有28.83万新发前列腺癌病例,约34700人将死于这种疾病。
关于Clarity Pharmaceuticals
Clarity是一家临床阶段的放射性制药公司,专注于严重疾病的治疗。该公司是创新型放射性药物的领导者,基于其SAR技术平台开发靶向铜治疗,主要用于儿童和成人的癌症治疗。