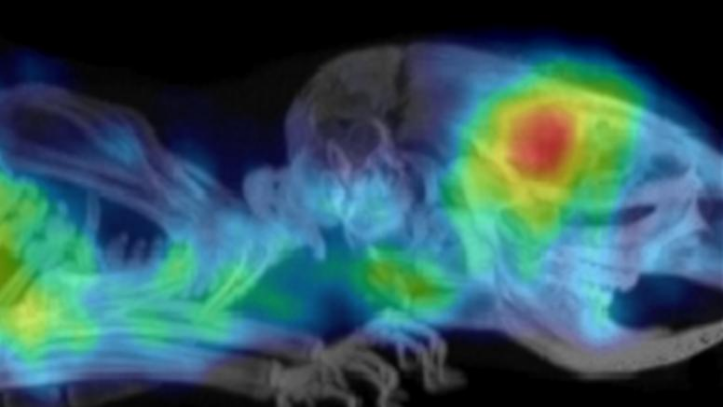
上图为小鼠模型中的胶质母细胞瘤的PET扫描图像,图片来源: ICR的临床前分子影像团队
一种新的筛查方式可能通过帮助确定哪些脑瘤患者最有可能从某些治疗中获益,从而提高快速增长的脑瘤患者的生存率。
在小鼠模型上进行的创新临床前研究表明,一种分子成像技术可以揭示胶质母细胞瘤中一种名为PD-L1的蛋白质的存在,胶质母细胞瘤是成人中最常见的癌症脑瘤类型。
检测高水平PD-L1的方法有助于指导治疗决策,再配合其他措施,从而可能改善患者的预后。
评估PD-L1表达水平
目前,科学家们通过对手术期间患者的组织样本进行免疫组化来评估PD-L1表达水平,这是胶质母细胞瘤的一线治疗方法。然而,这项技术容易受到人为错误的影响,而且对于这些患者或这种特定的肿瘤,这种技术在全球范围内没有标准化,结果也很难量化。
美国癌症研究所的研究人员表示,一种称为免疫-正电子发射断层扫描(immuno-PET)的非侵入性成像技术可能是一种更好的方法。
这项研究已发表在《Cancers》杂志上。该研究主要由ICR资助,ICR既是一个研究机构,也是一个慈善机构;部分由ICR的英国癌症研究融合科学中心、伦敦帝国理工学院和波兰国家科学中心资助。
免疫治疗可能改善胶质母细胞瘤的治疗前景
胶质母细胞瘤始于大脑细胞的生长。它生长迅速,通常在大脑内扩散,因此很难有效治疗。目前尚无治愈方法,最初对治疗有反应的患者往往会复发。平均生存时间只有12-18个月,只有5%的患者生存超过5年。
近几年来,免疫疗法已经显示出治疗胶质母细胞瘤的潜力。特别是,研究人员一直在测试一种被称为免疫检查点抑制剂的药物,这种药物可以阻止其他蛋白质抑制身体的免疫反应。迄今为止的结果好坏参半,表明该疗法可能只对一部分患者有效。
创造一种新型放射性示踪剂
ICR的团队成功地使用NOTA-maleinide将高亲和力ZPD-L1分子与氟-18和镓-68放射性核素连接起来。亲和体是一种小蛋白质,可以与靶蛋白紧密结合(本例中的PD-L1)。这一过程产生了18F-AIF-NOTA-ZPD-L1和68Ga-NOTA-ZPD-L1,具有高特异性,能够识别肿瘤细胞及其微环境中的PD-L1。
研究小组选择使用亲和体而不是抗体,因为亲和体的体积小得多,意味着它们可以更快地被身体代谢,减少患者的辐射剂量,并防止手术延误。使用亲和体还可以在注射后1小时获得高质量的图像。相比之下,当使用抗体时,图像通常要在48小时后才能获得。
尝试新方法
研究人员证明,这些放射性标记的亲和体可用于评估小鼠肿瘤中PD-L1的表达水平。PET扫描显示,虽然在健康组织中有一些放射性示踪剂的摄取,但高肿瘤/本底对比度使脑肿瘤清晰可见。
然后,研究人员调查了36例新诊断为胶质母细胞瘤患者的样本。他们在39%的样本中发现了PD-L1阳性膜染色。对161例人类胶质母细胞瘤样本进行的另一项分析证实,与其他胶质母细胞瘤亚型相比,具有间充质特征的肿瘤PD-L1表达水平显著升高,这与其对免疫检查点抑制剂的更好反应有关。该结果支持了以下观点:医疗专业人员可以使用immuno-PET来识别最有可能从免疫检查点抑制剂中获益的患者。
“非常令人兴奋”
研究人员希望这项工作将为30% - 49%的间充质亚型胶质母细胞瘤患者带来更好的结果。他们目前正在波兰进行一项临床试验,该试验建立在这项临床前研究的基础上,并希望在不久的将来能够展示该试验的数据。
ICR的临床前分子成像小组组长Gabriela Kramer-Marek博士说: “见证从实验室到临床的过程真的很令人兴奋。我们目前正在进行一项人体临床试验,之所以它能成为可能,得归功于这项有希望的临床前工作。该项试验是有史以来第一次使用immuno-PET来评估原发性胶质母细胞瘤患者的PD-L1,我们希望图像能清楚地显示PD-L1在这些脑肿瘤中的存在。
“胶质母细胞瘤的治疗方法几十年来未曾改变。虽然我们还没有找到治愈的方法,但我相信这种新型筛查方法肯定会改变患者的预后。”