ACE2(血管紧张素转换酶2)具有复杂调控机制,它在感染SARS-CoV-2后会发生动态变化,这可能是导致Covid-19疾病呈现出如此大的症状表现和多种变体的原因之一,研究表明,ACE2表达与疾病的严重程度呈正相关,而儿童的较低ACE2水平使他们免受严重的SARS-CoV-2感染,而老年人由于ACE2低表达又导致较差的预后,并且由于强烈的个体间差异,以及mRNA和蛋白质水平不同等因素,因此与年龄相关的ACE2表达存在矛盾陈述。另一种理论认为,感染SARS-CoV-2后ACE2的降解会打破RAAS中ACE的平衡,从而导致促炎状态,并增加严重疾病进展的风险。
近期大量的研究也进一步证实了 ACE2 表达水平与 Covid-19 严重程度之间的关系,如高血压、糖尿病和肥胖,以及遗传易感性和某些药物,都会影响 ACE2 的表达水平,并增加患上 Covid-19 严重疾病的风险。因此,更深入地了解 ACE2 表达水平的动态变化,有助于预测某人易感性和疾病进展,进而识别高风险患者,并制定更个性化的治疗策略。与之前只能通过 mRNA 和蛋白质水平测定各种组织中 ACE2 的表达不同,无创成像技术可以直接观察患者的 ACE2 表达动态。
在临床上,单光子发射计算机断层成像(SPECT)已经被广泛应用,而正电子发射计算机断层显像(PET)则相对较少使用。然而,PET具备图像分辨率更高、灵敏度更强以及准确定量选择等优势,因此,在许多医学情况下,尤其是心血管疾病相关的分子成像领域,PET成为首选。为了可视化ACE2,临床前研究人员尝试开发一种PET显像剂,最初使用碘-124标记病毒刺突蛋白受体结合域的方法进行实验。同时,其他研究小组采用二硫桥接DX600,并通过DOTA或NODAGA螯合剂衍生化,使其与镓-68作为PET放射性核素配位。一种名为DX600-bch的nota衍生物用于配合氟化铝-18,并目前正在临床试验中,以探索ACE2的非侵入性定位的可能性。
研究小组主要对基于dx600的放射性示踪剂进行更深入的研究,使其适用于ACE2的无创PET成像,通过分子建模的方,,分别设计了具有DOTA、NODAGA和HBED-CC螯合剂的3种多肽与镓-67 (T1/2 = 3.26 d)标记后进行评估,作为镓-68 (T1/2 = 68 min)的替代放射性同位素,因为镓-67的半衰期更具优势,可以用于SPECT成像。利用转染ACE2和ace的人胚胎肾(HEK)细胞和各自的异种移植小鼠模型,评估基于dx600的放射性多肽对ACE2的选择性。合成了一种基于缓激肽增强肽-9a (BPP9a)结构的ace特异性放射肽,并衍生出金属螯合,以验证体外和体内模型。
SPECT/CT实验结果:
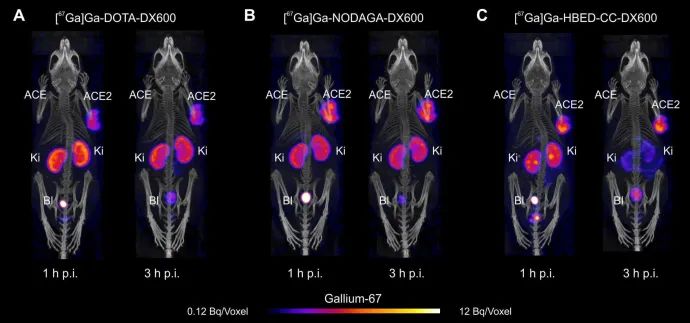
数据显示,[67Ga]Ga-HBED-CC-DX600作为放射性示踪剂是非常有潜力的。它能够研究ACE2在体内的表达和动态变化,从而更好地了解 Covid-19 的病理机制。与其他使用DOTA或NODAGA螯合剂的基于DX600的放射性多肽相比,[67Ga]Ga-HBED-CC-DX600在生物分布方面更具优势。尤其重要的是,HBED-CC螯合剂能够以高摩尔活性标记67Ga,这对于获取高信噪比图像以检测患者生理ACE2表达水平至关重要。
研究机构:
瑞士保罗谢勒研究所(Paul Scherrer Institute,又称瑞士保罗谢尔研究所,简称PSI)是瑞士国家研究所。与国内外大学、其他研究机构和工业界合作,在固态物理、材料科学、基本粒子物理、生命科学、核与非核能研究及与能源有关的生态学的研究中非常活跃。
PSI研究的重点放在基础研究和应用研究,特别是与可持续发展有关的领域和对教育和培训具有重要意义、但超出大学单个系能力的领域,它也是世界范围内多国科研用户的主要的实验室之一。