除个别案例外,目前临床抗生素剂量一般基于血浆浓度来使用,但没有关于感染部位药物浓度的信息,而靶组织中不适当的抗生素水平会导致患者体内耐药菌株的出现、以及对患者周围正常组织带来额外的药物毒性甚至器官损伤,进而导致治疗失败,因此大多数研究者和美国FDA也越来越重视在临床治疗中监测受感染组织中的抗生素浓度。基于此,约翰斯·霍普金斯大学感染和炎症成像研究中心Sanjay Jain研究团队开发了一种基于正电子发射断层扫描(PET)的临床转化技术,可用于研究动物和人类无创、实时、无偏差的抗生素浓度–时间曲线。在这项工作中,研究团队报道了18F-pretomanid作为分子影像示踪剂的研发历程,团队利用小鼠和兔的结核性脑膜炎模型的临床前动物研究,非侵入性评估全身药物的生物分布。简而言之,对受感染的动物进行18F-pretomanid PET/CT动态扫描,通过定量感兴趣体积(VOI)中的放射性摄取差异,获得时间-活动曲线(TACs)和曲线下面积(AUCs),并在成像后对动物模型实施安乐死,进行放射自显影和组织学检查。考虑到pretomanid治疗方案在结核性脑膜炎的未知潜力,同时与贝达基林(B)、前胺(P)和利奈唑胺(L)的治疗方案进行对比,主要采用质谱法和传统微生物学技术,纵向评价脑实质内药物水平和杀菌效果[用菌落形成单位(CFU)定量的细菌负荷]。
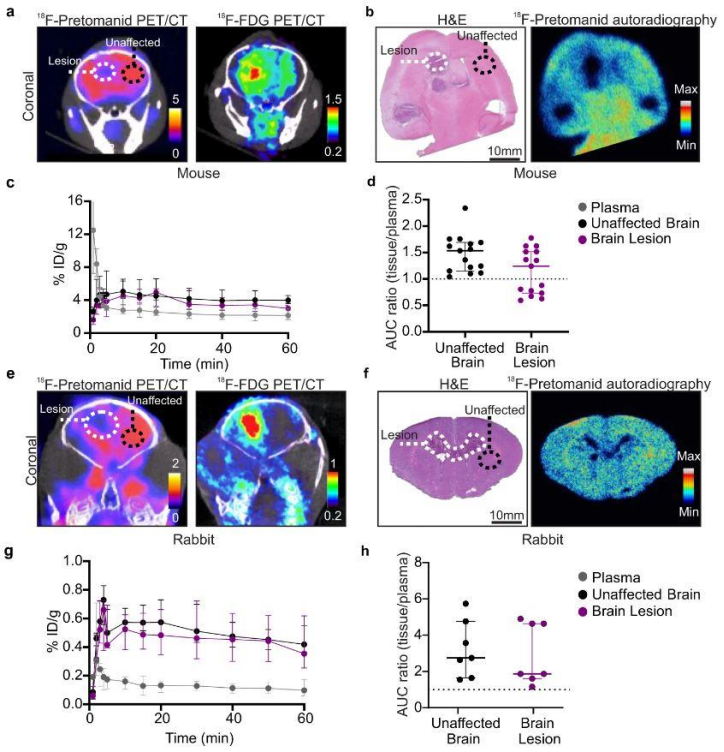
小动物PET/CT成像和定量分析。在肺结核小鼠模型中,18F-pretomanid的全身生物分布结果表明,其对脑实质的渗透性非常高,AUC中值(脑/血浆)为1.73(IQR,1.41–2.04),即使在健康大脑中也是如此,因此Sanjay Jain研究团队在两种不同的结核性脑膜炎哺乳动物模型中展开了18F-pretomanid渗透性研究,结果显示18F-pretomanid具有良好的脑渗透性[AUC比率(脑/血浆)>1],然而,在结核性脑膜炎小鼠模型中的体内3D PET/CT和2D离体放射自显影显示18F-pretomanid在脑损伤区域摄取低于正常组织(a,b),脑损伤的AUC比率(脑/血浆)为1.35(中位数;IQR,0.81–1.52),正常脑组织为1.56(中位数;IQ R,1.22–1.69)(c,d);同样在兔结核性脑膜炎模型中也发现了类似的结果(e-h),脑损伤的AUC中值(脑/血浆)为1.87(IQR,1.66–4.63),未受影响的脑AUC中值为2.75(IQR:1.64–5.73)。
结论:
放射性标记抗菌素的使用,结合传统微生物技术和新的动物模型,针对同一宿主复杂和异质性病变无创评估感染组织中的PK实验方面具有巨大潜力。研究团队的工作表明,pretomanid具有良好的中枢神经系统渗透性,这在18F-pretomanid研究中首次得到证实,这也表明,结合其他抗MDR菌株的抗生素,也具有良好的脑渗透。最后,作者的研究重申了抗生素进入中枢神经系统的区域化和不一致的渗透,这与抗生素的物理化学性质有关。
研究团队介绍:
约翰斯·霍普金斯大学医学院,在全美公共卫生学院排名第一,其中感染和炎症成像研究中心作为核心跨学科中心,为基础医学研究团队提供最先进的小型动物成像设备,包括PET、SPECT、CT和US,以支持约翰·霍普金斯大学及其他不同相关研究领域的广泛科研项目,其主要目标是诊断、治疗和监测感染和炎症过程。该中心以约翰斯·霍普金斯大学医学院为基础,服务于包括儿科医学、放射医学和肿瘤学及传染病学在内的多个强势学科,其中传染病和放射学科正在开展重大合作,旨在开发新的方法,直接用于结核分枝杆菌或与结核相关的炎症进行成像,并对疗效进行监测。