
有限射程的充分利用
2000年,关于IMRT的大部分研究已经完成,质子治疗具有更多的发展机会。2001年,Northeast质子治疗中心是世界上第二家以医院为基础的质子治疗中心(现在已有100多个)。质子束的有限射程是其主要的物理优势,但由于存在较大的射程不确定性(厘米级)而不能用于保护危及器官。减少射程的不确定性成为研究目标,直到今天,仍然是MGH小组和世界各地的许多其他小组的研究重点。
减少射程不确定性的最佳方法是直接测量治疗患者体内的质子射程,并进行校正。德国达姆施塔特GSI的碳离子治疗研究项目,将PET成像用于可视化碳离子照射后组织的活化,以显示剂量实际递送的位置。有研究表明,质子束也有可能实现同样的效果,但尚不清楚这种方法在临床上的可行性。从2004年开始,对质子治疗后的PET扫描进行临床研究,首先在放射科使用PET扫描仪,后来在治疗室使用移动PET扫描仪,可以捕获寿命较短的氧-15信号。在评估质子射程时要达到毫米级精度非常困难,主要原因是信号的生物冲刷,总体而言低信噪比,以及由于激活阈值大约为20 MeV导致射程最末端没有信号。
在与MD Anderson Cancer Center质子中心(包括Radhe Mohan和Lei Dong在内的物理学家)合作中设定了一个目标,即将射程不确定性降低到1 mm。通过结合各种成像技术可实现,包括双能计算机断层扫描(DECT)来获得质子阻止本领,以及磁共振成像(MRI)来测量辐射剂量递送导致的组织变化。一个相关的新想法是测量质子与组织的核相互作用中产生的瞬发伽马辐射,而不是测量PET扫描仪中β+衰变。快速伽马能谱仪逐渐被应用于临床。
尽管做出了这么多努力,目前仍没有完全实现以1 mm精度测量患者体内质子射程的目标,更不用说将射程不确定度降低到相同水平。这一问题因靠近射程末端的相对生物效应(RBE)的不确定性而进一步加剧。因此,目前利用质子布拉格峰的远端进行剂量适形仍然是难以实现的。
治疗计划和计划优化
从治疗计划问题来看,调强质子治疗(IMPT)中的计划优化与光子IMRT中的相应问题没有本质区别。由于多叶准直器(MLC)在质子治疗中并不像IMRT中那样必不可少,束流分布图可以或多或少地直接用于笔形束扫描的递送,使治疗计划实际上更加简单。然而,质子治疗计划中还有几个额外的挑战:存在更多的变量,因为要确定每个射束方向的强度和能量;较小的笔形束尺寸会导致治疗过程中束流传递序列和内部器官运动之间产生更严重的相互影响,使得4D计划变得更为关键;虽然RBE增加了一层不确定性,但可以利用传能线密度(LET)来优化空间剂量分布。
在本世纪初,为解决质子治疗中的射程不确定性问题,定义了许多治疗递送情景,包括射程过度和不足,并确定了最坏情景下的最佳方案,或所有情景中目标函数期望值有关的最佳方案。此后,鲁棒性优化被纳入商业治疗计划系统,并被常规应用于质子治疗。然而,为了通过鲁棒性优化保护治疗计划不受不确定性影响,就必须付出降低计划质量的代价。
在治疗过程中多次甚至每天执行自适应治疗计划,是减少可变性和不确定性的一种方法,在质子治疗中更为重要。目前,正在大力开发人工智能来促进自适应质子计划的发展。进行自适应计划和递送的方式是实时自适应,可以对患者进行灵活而精确的定位,实现质子治疗的普及化。
对现有建筑进行质子治疗改造
使质子治疗更经济实惠的一个方法是将质子系统整合到现有建筑中,而不是在未开发的土地上建造专用的新建筑。2013年,麻省总医院(MGH)需要增加更多的质子治疗系统,并且必须位于主校区,靠近现有的质子治疗中心。在新近完工的建筑中需要两个地坑,为直线加速器进行光子放射治疗的治疗室。这些房间位于地下3层,无法从上方或侧面直接吊入系统。将系统设备运入这些房间的唯一途径是通过现有的电梯和走廊。这一限制使组件较小的同步加速器成了唯一选择,并将其放置在一个直线加速器地坑中。另一个地坑可以容纳一个紧凑型半角度机架。在经过大量的规划,并克服了在急诊科正下方安装该系统的诸多挑战后(见图3),第一例患者于2020年初接受了质子治疗,为未来质子治疗的“普及化”提供了方向。
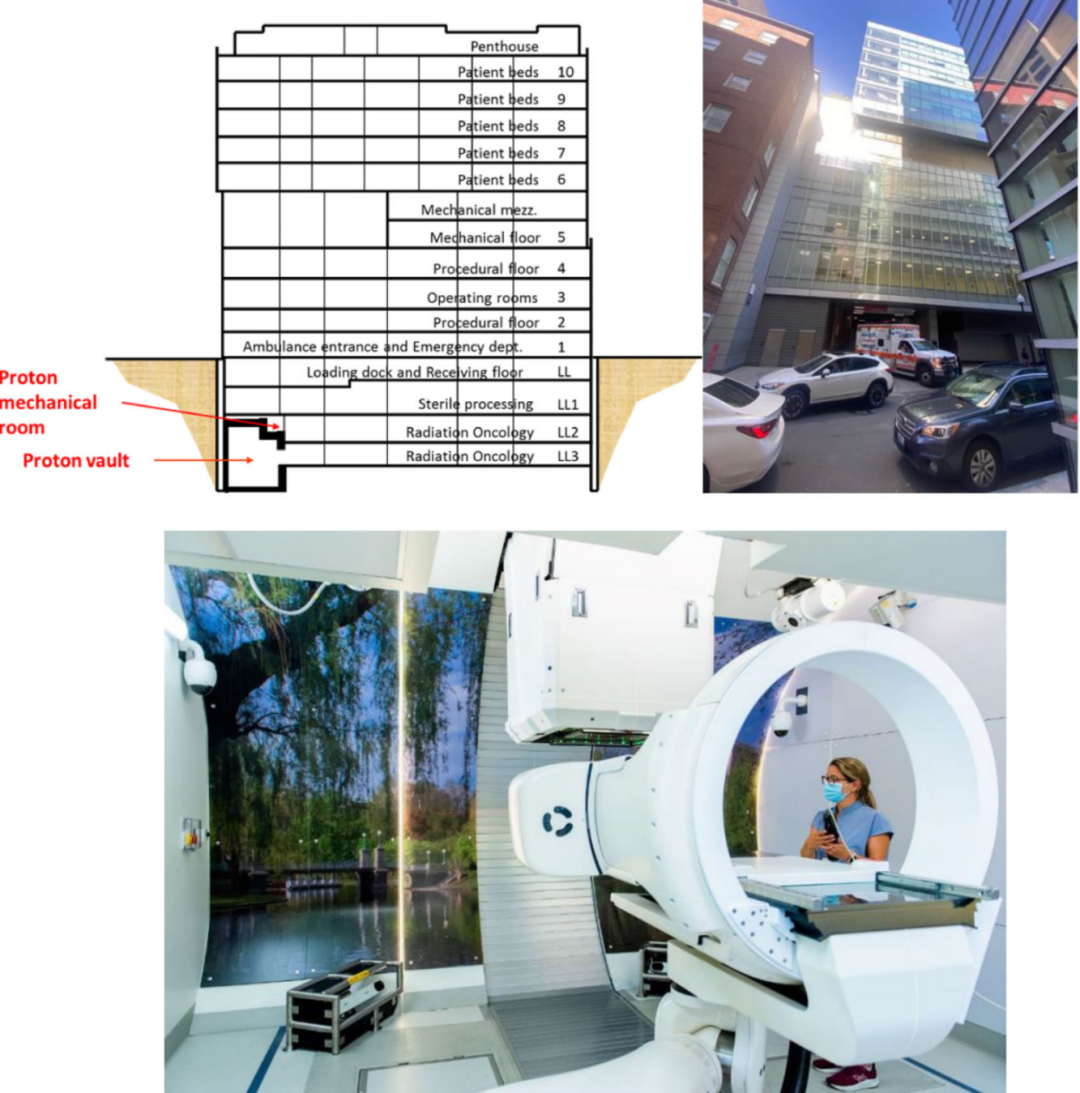
图3.波士顿麻省总医院Lunder大楼的示意图(左上)和照片(右上),在图中救护车入口下方的地下2层和3层安装了一台质子治疗系统。