
在此之前,一些研究表明超高剂量率照射(FLASH)在保持肿瘤部位接受标准剂量的同时,能进一步降低对周围正常组织的毒性。2014年,研究人员使用4.5 MeV的电子束照射小鼠肺部肿瘤,首次证明了FLASH效应。与常规剂量率相比,FLASH照射使小鼠的肺纤维化更少。对小鼠进行全脑照射结果表明,FLASH显示出独特的记忆力保留,在迷你猪和患有鼻鳞状细胞癌的猫身上进行FLASH研究,也几乎没有观察到皮肤毒性。
材料和方法
PSI的Gantry 1
PSI的Gantry 1是世界上第一个用于笔形束扫描的装置,于1996年到2018年底一直用于患者治疗。旋转机架的半径为2 m,即便从当下看也是一款紧凑型的机架。由于机架是偏心的,治疗床伴随机架的旋转可以垂直移动,因此并没有真正的等中心。磁铁扫描是利用一种称为sweeper的快速扫描磁体在横向(U)方向上实现的,点与点之间的间隔时间为几毫秒。深度方向上的扫描通过机架喷嘴中的射程移位器来实现,该射程移位器由39块物理厚度为4.53 mm的聚苯乙烯(PS)板和1块约一半其厚度的PS板组成。它们以气动方式驱动,每个板的间隔时间为60 ms。这一功能为将一个未降能的质子束传输到等中心提供了独特的机会,以最大限度地提高束流强度,从而提高剂量率。最慢的扫描方向(T)通过治疗床的移动来实现,移动速度为30 mm/s。图1展示了治疗室内机架的全景图,从治疗室可以看到−90°角,突出显示的是点扫描轴和运动、本文定义的“等中心”,以及用于实验的法拉第杯。

图1. 瑞士保罗谢尔研究所治疗室内Gantry 1全景图
FLASH束流传输
用于治疗用的质子束由COMET回旋加速器产生。加速器引出的束流能量和最大强度分别为250 MeV和1 μA。能量调节通过安装在回旋加速器之后的降能器实现。在Gantry 1的日常治疗中,前面提到的射程移位器被用于能量的进一步精细调节。然而,由于质子束在降能材料中发生的散射,降能器引入了大量的流强损失。当降能到较低能时,传输到治疗室的束流流强比例低于1%。为了达到超高剂量率,必须通过优化束流参数,以最小的损耗将回旋加速器产生的250 MeV束流传输到治疗室。束流线的长度为44 m,包含了约40个二级铁和四级铁。研究人员使用TRANSPORT进行束流光学的模拟和计算,以找到初始的磁体设置,并作为进一步实验微调的参考。到机架耦合点的束流传输效率定义为机架耦合点与回旋加速器引出点的束流强度的比值,可通过沿束流线安装的流强探测器测量得到。耦合点到等中心的束流传输效率定义为等中心处的流强与耦合点实测流强的比值。等中心处的束流流强可通过等中心处放置的法拉第杯测量到的质子总电荷和测量的传输时间计算得出。
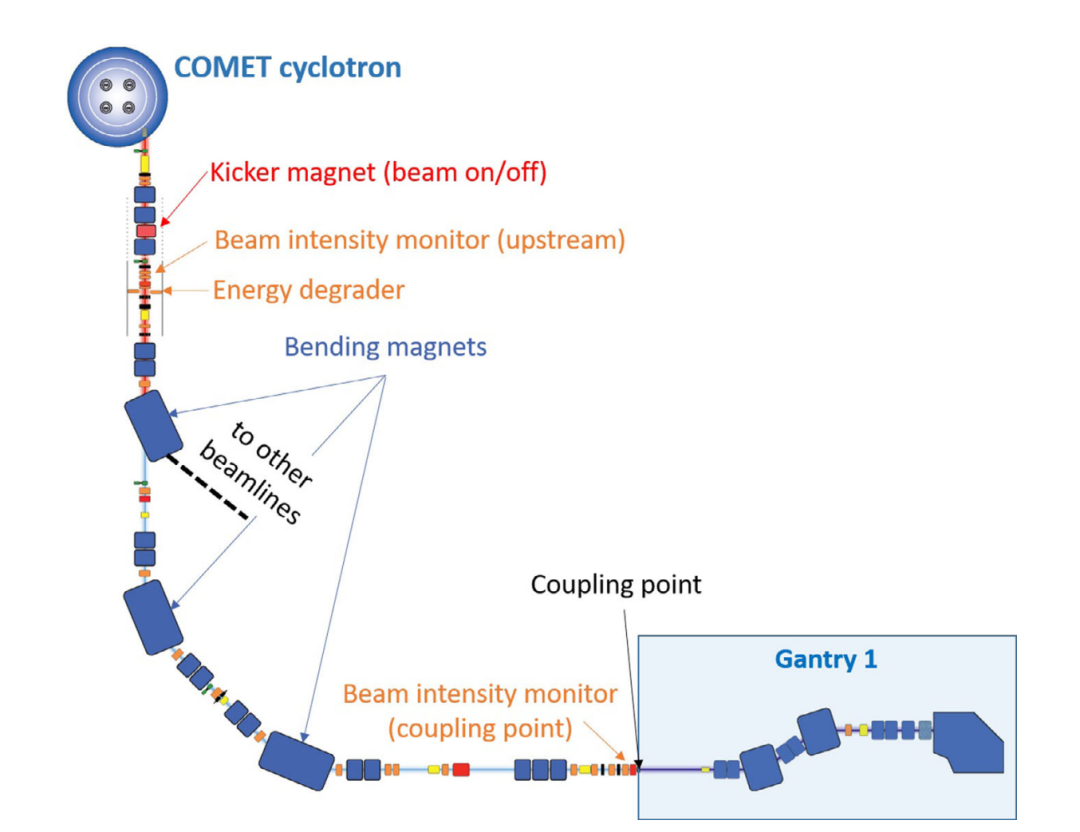
图2. Gantry 1束流线示意图
FLASH照射下的剂量监测
Gantry 1在喷嘴中安装两个平行板电离室,位于射程移动器之前,用于控制输送的剂量。第一个是主监测电离室,用于控制剂量传输,电荷收集时间为90 μs;第二个是备份监测电离室,它是治疗验证系统的一部分,电荷收集时间为350 μs。假设FLASH照射时间为10 ms量级,剂量率高达每秒几千Gy,主监测电离室也能保证精度至少为1%。
相比于治疗时使用的剂量率,在FLASH实验中期望的瞬时剂量率是常规剂量率的100~1,000倍。电离室在如此高的剂量率下,电荷复合效应损失的影响会很大。因此,需要对监测电离室彻底了解。为了提供准确的剂量监测,研究人员对监测电离室与法拉第杯进行了校准。通过法拉第杯测得的电荷量和质子在特定束流能量下的阻止本领来确定传输至水中的积分剂量。根据0.3 mm分辨率的CCD闪烁体探测器测量到的光束轮廓,可以重构出与光束轴线正交的平面上的剂量分布。因此,最大局部照射剂量被定义为照射到对应高斯光束剖面最大值点的剂量。最大局部剂量率则由估计的最大局部剂量和控制系统提供的测量传输时间决定。
不同剂量率传输
由于COMET回旋加速器的射频频率为72.85 MHz,研究人员假设回旋加速器产生的束流是连续的。因此,每间隔14纳秒传输一次0.8纳秒的长光束脉冲。因此,在单束脉冲中,剂量率比在连续束假设下高17.5倍。然而,单个脉冲的时间很短,以至于在其中传递的剂量极低。即使在剂量率为1,000 Gy/s的FLASH中,每脉冲的剂量在10 μGy量级。此外,就离子复合而言,剂量传递可以被认为是连续的。