该2b期多中心试验旨在评估常规治疗后复发性GBM患者通过对流增强输送导管直接注射铼(186Re)obisbemeda的安全性、耐受性、分布和疗效。
医学、神经学和神经外科教授,Kolitz/Zachary神经肿瘤学研究主任,圣安东尼奥德克萨斯大学健康科学中心实验和发展治疗项目的共同负责人,ReSPECT GBM临床试验的首席研究员Andrew J. Brenner博士说:“在1/2a期剂量递增试验中,我们发现,在8.8 mL的输注体积中,22.3 mCi的铼(Re)obisbemeda辐射剂量是安全的,总体存活率与肿瘤吸收的辐射剂量以及治疗体积中肿瘤体积的百分比之间存在统计学上的显著相关性。这种相关性的强度对于1/2a期试验来说是非常积极的,我们乐观地认为,这些安全性和有效性将在正在进行的2b期试验中得到确认。”
预计2b期试验将在大约24个月内额外招募至少31名患有中小型肿瘤(20毫升或更少)的患者。该试验得到了美国国立卫生研究院(NIH)下属的国家癌症研究所(NCI)的资助。
Plus Therapeutics首席医疗官兼高级副总裁Norman LaFrance医学博士表示:“我们已经成功完成了两个关键的近期临床开发目标,具体来说就是制造cGMP铼(186 Re)obisbemeda,并将我们的胶质母细胞瘤计划推进到2b期。我们第一位患者的治疗进展顺利,高剂量铼(186 Re)obisbemeda的靶向肿瘤递送效果极佳,与我们在1/2a期试验中看到的相同剂量相似。展望今年,我们的重点将是扩大试验点和增加受试人数,以加速这种新型治疗方案的临床开发。”
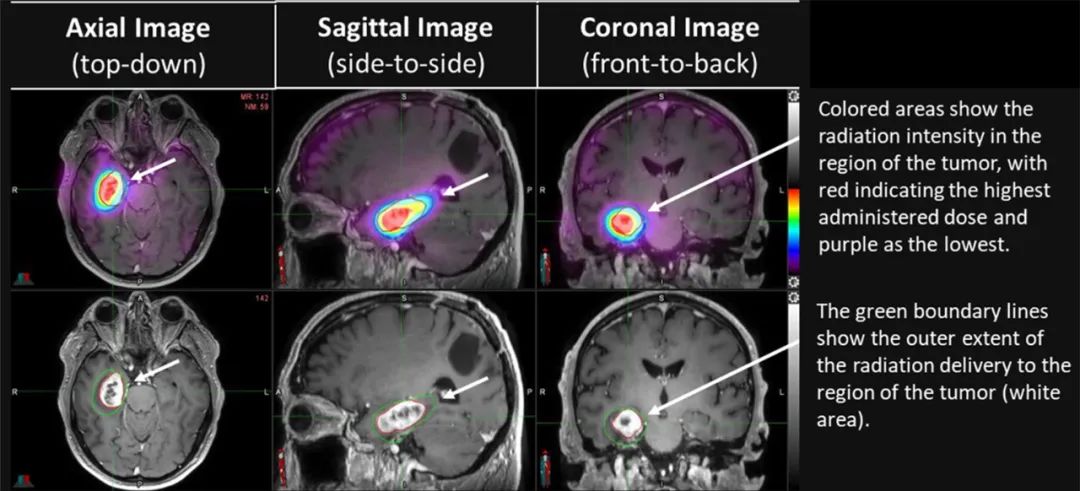
图:ReSPECT GBM 2b期试验中接受治疗的第一名患者的初始治疗图像。
正如2022年11月在在第27届年度科学会议和神经肿瘤学会教育日所披露的,24例复发性GBM患者的1期ReSPECT GBM铼(186Re)obisbemeda临床试验结果表明,患者的总体生存率,肿瘤的平均吸收辐射剂量和治疗的肿瘤体积百分比,都存在统计学的显著改善。该治疗安全且耐受性良好,没有剂量限制性毒性。
美国食品和药物管理局(FDA)授予铼(186Re)obisbemeda治疗GBM的孤儿药和快速通道。
关于复发性胶质母细胞瘤(GBM)
在美国,GBM每年影响大约14490名患者,是最常见和最致命的脑癌症。GBM患者的平均预期寿命不到24个月,一年生存率为40.8%,五年生存率仅为6.9%。复发性GBM患者没有明确的护理标准,即使是目前批准的少数几种治疗方法也只能提供有限的生存益处,并伴有严重的副作用,从而限制了剂量和长期使用。大约90%的患者在原始肿瘤位置或附近经历GBM肿瘤复发,但在复发或进展性环境中,没有FDA批准的治疗方法可以显著延长患者的寿命。
关于铼(186Re)obisbemeda
铼(186Re)obisbemeda是一种新型的可注射性放射治疗,尤以安全、有效和方便的方式在中枢神经系统肿瘤中提供高靶向高剂量辐射,以优化患者预后。与目前批准的治疗方法相比,铼(186Re)obisbemeda具有降低中枢神经系统癌症患者风险和改善预后的潜力,具有更具针对性和更强的辐射剂量。铼的半衰期短,β能用于破坏癌组织,γ能用于实时成像,因此铼是CNS治疗应用的理想放射性同位素。
关于Plus Therapeutics
Plus Therapeutics是一家临床阶段的制药公司,围绕难以治疗的中枢神经系统癌症开发靶向放射治疗药物,提高患者肿瘤治疗的临床疗效。结合图像引导的局部β射线和靶向药物递送方法,该公司正在推进一系列候选产品,其中包括针对复发性胶质母细胞瘤(GBM)和软脑膜转移瘤(LM)的主导项目。公司通过战略合作伙伴关系建立了强大的供应链,使其产品的开发、制造和未来潜在的商业化成为可能。此外,Therapeutics由一支经验丰富、敬业的领导团队领导,在包括德克萨斯州奥斯汀和圣安东尼奥在内的主要癌症临床开发中心开展业务。