2023年1月16日,中国科学院生物物理研究所孙飞,季刚,朱赟作为共同通讯在《Nature Methods 》杂志在线发表了题为"ELI trifocal microscope: a precise system to prepare target cryo-lamellae for in situ cryo-ET study"的研究论文,介绍了由中国科学院生物物理研究所蛋白质科学研究平台生物成像中心自主研发的三束(电子束Electron beam, 光束Light beam,离子束Ion beam)共焦荧光实时监控的聚焦离子束精准减薄系统--ELI-TriScope。ELI-TriScope系统在商用双束扫描电子显微镜内部整合了一个基于冷冻样品杆的传输系统(cryo-transfer system),以及一个内嵌的光学成像系统(cryogenic SimulTAneous monitoR system, cryo-STAR)。该系统在扫描电镜的内部将电子束,光束和离子束同时聚焦在样品台上同一位置,实现了聚焦离子束减薄样品的同时进行荧光实时监控成像。该系统通过监测目标分子的实时荧光信号,能够精确且高效地制备包含目标结构的冷冻含水切片。借助ELI-TriScope,研究团队以约91%的成功率从HeLa细胞中制备得到72片包含中心体的含水切片样品,并通过随后的冷冻电子断层数据分析,发现了人体中心体新的原位结构特征。该研究结果证明,ELI-TriScope作为一种先进的、精确的、高效的冷冻聚焦离子束(cryo-FIB)减薄技术,在未来原位结构生物学研究体内特定事件的高分辨率超微结构领域具有极大应用潜力。

"眼见为实",细胞超微结构的三维可视化是理解生命的重要一步。随着技术的快速发展,冷冻电子显微镜(cryo-EM)单颗粒分析技术已成为体外研究生物大分子三维高分辨率结构的重要工具之一。同时,冷冻电子断层成像也迅速发展成为研究生物大分子复合物的原位高分辨率结构及其原位相互作用关系的关键技术。然而目前,冷冻电子断层技术广泛有效地应用于原位结构研究仍存在许多障碍,特别是在样品制备方面,现有的冷冻样品制备技术实验效率低、定位精度低。冷冻聚焦离子束可以制备出表面平整的冷冻含水切片,被广泛应用于原位结构生物学研究所需的高质量细胞冷冻含水切片的制备,并获得了许多成功的应用。此外,为了实现聚焦离子束精准制备包含特定目标结构的冷冻含水切片样品,冷冻光电关联成像技术(cryo-CLEM)也应运而生。传统的冷冻光电关联成像工作流程需要一个独立的冷冻荧光显微镜用于冷冻荧光成像,随后再将样品送入冷冻扫描电子显微镜(cryo-SEM)中,通过关联对齐软件将冷冻荧光图像和冷冻扫描电镜图像之间进行关联匹配,用于指导后续聚焦离子束减薄。由于该技术流程涉及冷冻样品在多种显微镜之间的转移,导致光电关联成像操作复杂,且成功率较低。在该技术流程中,荧光标记目标物的三维空间位置是影响定位精度的关键因素,然而,这些信息只能通过宽场荧光成像或冷冻激光扫描共聚焦显微成像(CACM)来大致确定,但受限于冷冻荧光显微镜的光学分辨能力,光电关联对齐精度有限,难以实现精准定位胞内稀少、微小的目标结构。
最近几年来,有研究提出将荧光成像系统集成到冷冻双束扫描电镜的真空腔室内,以避免样品在不同设备间的多次转移。商用的集成型光电关联设备包括iFLM(赛默飞科学公司,美国)和METEOR (Delmic,荷兰)。使用这些集成系统,可以在聚焦离子束减薄前后在扫描电镜内部对冷冻样品进行冷冻荧光成像,并完成关联对齐,因不涉及样品转移,故有效减少了冰污染的风险。然而,由于嵌入冷冻扫描电镜内的光学物镜的数值孔径(NA)较低,这些集成的光学成像分辨率普遍较低,从而影响后续图像关联精度,且该设备需要将样品从冷冻荧光成像系统和冷冻FIB成像之间频繁切换,大大影响了聚焦离子束对目标物的减薄效率。
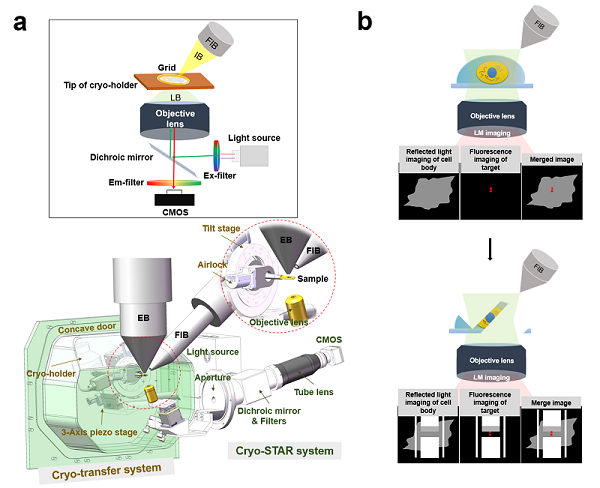
图1.ELI-TriScope的设计原理。(a)ELI-TriScope的光路原理图(上)及系统设计图(下)。IB,离子束。LB,光束。EB,电子束。FIB,聚焦离子束。(b) ELI-TriScope的工作原理示意图。离子束和光束同时聚焦在冷冻样品中感兴趣的区域,反射光成像(灰色)显示细胞轮廓,荧光信号(红色)用于实时监控cryo-FIB精准减薄。
为了解决上述技术难题,基于生物成像中心之前开发的基于高真空冷台的光电关联成像系统(High-vacuum Optical Platform for cryo-CLEM, HOPE)及其技术流程的研究基础上,研究团队基于双束扫描电镜(FEI Helios 600i)新研制了ELI-TriScope系统(图1)。ELI-TriScope中集成了一个基于冷冻样品杆的传输系统(cryo-transfer system),并在冷冻样品下方嵌入了一个倒置荧光成像系统(cryo-STAR system)(图1a),从而实现电子束(E)、光束(L)和离子束(I)被精确地聚焦到同一点上,经过对齐校准,通过监测目标分子真实的荧光信号,实现实时、精准地导航聚焦离子束减薄(图1b)。使用ELI-TriScope,不需要添加荧光珠等基准标记,也避免了冷冻样品在冷冻光镜和冷冻扫描电子显微镜之间的传输以及图像对齐,与其他冷冻光电关联成像技术相比,ELI-TriScope有效提高了冷冻聚焦离子束减薄的效率、准确性、成功率和样品制备通量。
随后,研究团队选择人源细胞的中心粒作为原位结构研究的目标。在大多数情况下,每个细胞中仅存在一个中心体,即两个中心粒。因此,对于哺乳动物细胞来说,在没有荧光信号导航时,使用传统的聚焦离子束减薄获得含有中心粒的切片用于其原位结构研究是十分困难的。而ELI-TriScope的研发则解决了这一难题,通过荧光标记,ELI-TriScope成功制备了一批精准靶向中心体的冷冻含水切片样品,对HeLa细胞内中心粒的捕获成功率可达91%。
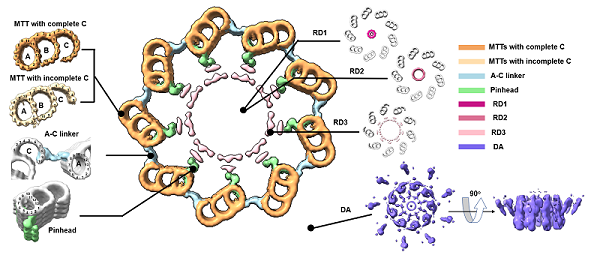
图2. 人体中心粒的原位结构。中央大图展示cryo-ET技术解析获得的人中心粒横截面图。MTTs,微管三联体;RD1-3,中心粒内部环状密度;DA,远端附属结构。A-C linker,A管C管连接区。Pinhead,针头状结构。
随后,研究团队对制备出的72片包含中心粒的冷冻含水切片进行电子断层数据收集及亚电子断层平均处理(sub-tomogram averaging)。实验结果(图2)证实了人类中心粒中各种典型成分的超微结构,包括维持中心粒9重对称性最重要的两种微管三联体结构(microtubule triblets,MTTs),即拥有完整C管的三联管和不完整C管的三联管;连接三联管中A管与相邻MTT中C管的A-C linker;连接A管与中心粒内部结构的pinhead等,这些结构的最高分辨率为2.5 nm。此外,研究人员通过手动挑选颗粒对中心粒内部结构进行了计算,发现其存在三种不同直径的环状密度结构(ring density,RD)。根据其直径大小,这些结构分别命名为RD1、RD2、RD3。其中,RD3是此前在其它物种中心体相关研究中从未报道过的结构,其直径在100 nm左右,由27个排列规则的点状密度组成。在观察到RD3的电子断层重构体中,发现其与存在于中心粒远端的附属结构(distal appendages,DAs)与亚附属结构(subdistal appendages,SDAs)总是同时出现,因此, RD3可能在维持中心粒远端区域内部的凝聚力中起到重要作用。
综上所述,ELI-TriScope为原位结构解析研究提供了一种非常成功的解决方案,将在未来的原位结构生物学中得到广泛的应用。
中国科学院生物物理所孙飞研究员、季刚正高级工程师和朱赟研究员为本文的共同通讯作者,蛋白质科学研究平台生物成像中心高级工程师李硕果、孙飞课题组博士生王子岩为该项工作的共同第一作者,生物成像中心贾星工程师在冷冻荧光样品制备、牛彤欣工程师在数据处理、张建国高级工程师在冷冻传输装置研制、工程师助理张小云在冷冻光镜成像、孙飞课题组博士生殷国良在冷冻电镜数据处理方面参与了该项研究。该研究获得国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项(B类)、中国科学院任务/知识创新工程重要方向项目的资助。样品制备、数据收集和分析等工作受到生物物理所蛋白质科学研究平台生物成像中心相关工作人员的大力支持和帮助。