免疫治疗近年来备受关注,是肿瘤治疗领域的研究热点。肿瘤免疫治疗通过输入外源性的免疫活性物质,从而逆转肿瘤微环境中的免疫抑制状态,激发机体持久特异性的抗肿瘤免疫响应,实现杀伤肿瘤细胞,抑制肿瘤生长的目的。
机体免疫系统极其复杂,特别是其发挥功能时呈现动态多样性[1]。分子影像技术以其高灵敏度、高分辨率以及精准定量分析的特点,为无创监测肿瘤免疫治疗过程中的全身免疫应答提供了可能性,在免疫疗法患者筛选、疗效监测与评估中发挥了重要价值和作用。
临床广泛使用的18F-FDG为非特异性的糖代谢显像剂,在鉴别免疫疗法诱导的炎症反应与肿瘤残留、复发方面仍然存在一定的局限性和挑战。免疫PET显像(immuno-PET)通过放射性同位素直接标记免疫相关靶点,显著提高了成像特异性,实现了免疫细胞、免疫活性物质的精准定位和功能状态、治疗反应的实时监测[2]。根据不同的免疫标记技术,免疫PET显像可分为以下三类[3]。
直接标记示踪技术
对于肿瘤免疫治疗的在体可视化显像监测,最初采用的方法是在过继性细胞免疫疗法(Adaptive Cell Therapy,ACT)中使用放射性示踪剂直接标记免疫细胞,将标记好的免疫细胞回输到患者体内,进行核素显像示踪细胞。
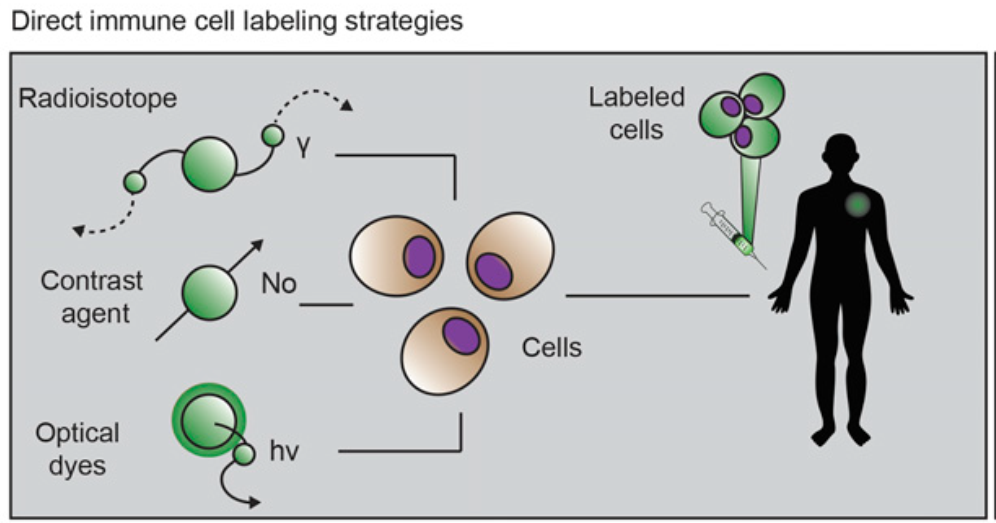
直接标记的示踪技术直观揭示了免疫功能重建和免疫细胞向淋巴结和肿瘤部位归巢的全过程,但体外标记过程中使用的大剂量放射性核素会对免疫细胞的功能和状态产生一定影响,并最终影响到免疫细胞的抗肿瘤活性。此外,标记的免疫细胞在体细胞分裂使得示踪剂信号可能被稀释,直接标记的示踪剂也无法区分免疫细胞活性,免疫细胞在体死亡会进一步带来假阳性风险。

基于单抗示踪技术
分子靶向治疗以及免疫检查点抑制剂的快速发展为免疫PET带来了新的可能。目前很多靶向药物及免疫检查点抑制剂均为单克隆抗体,通过放射性核素标记靶向肿瘤细胞或肿瘤微环境受体的单抗,进而PET显像,可以无创揭示肿瘤部位的靶点动态表达。目前开展临床研究较多的肿瘤细胞靶点和肿瘤微环境靶点包括HER2、EGFR、PD-1/PD-L1及CTLA-4等。
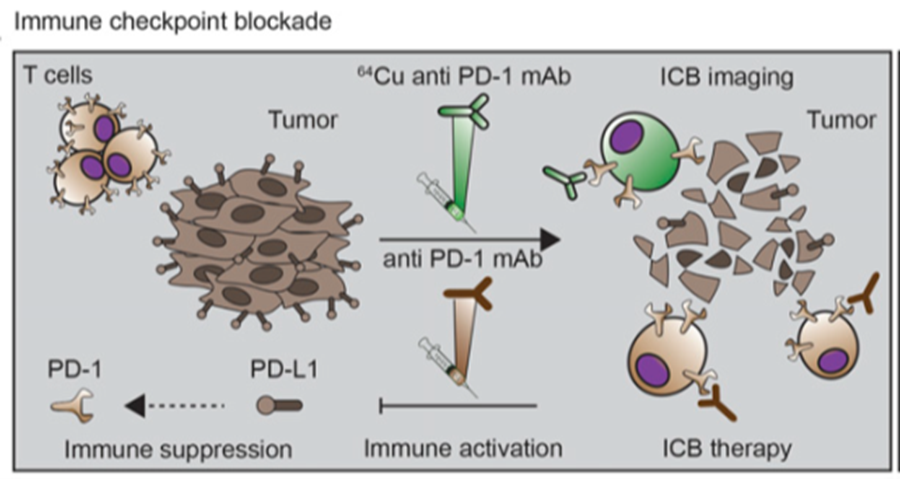
单抗探针具有稳定性强、特异性高的优势,但是单抗分子量约为150kDa,相对较大,使得其在体内具有较长的清除阶段,常需要在注射后等待数天才能得到理想靶本比的图像,因此单抗探针一般需要匹配半衰期较长的放射性核素,如Zr-89(半衰期78.4h)、I-124(半衰期100.3h)、Cu-64(半衰期12.7h)等。
报告基因示踪技术
报告基因示踪技术在体外通过基因工程学技术将报告基因转染至免疫细胞内,然后将基因修饰后的免疫细胞回输到患者体内。报告基因在体内表达成功的报告蛋白能够和放射性核素标记的报告基因探针特异性结合,通过PET显像实现免疫细胞的在体实时监测。根据报告基因探针与报告蛋白之间相互作用方式和作用区域的不同,可将报告基因分为酶类报告基因、转运体报告基因和结合蛋白报告基因。
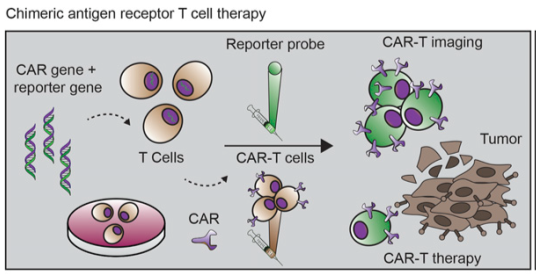
报告基因示踪技术实现了免疫细胞在体内的实时、长期、动态、重复性监测,尤其是在免疫细胞功能状态和活化状态监测方面具有显著优势。但是这种方法需要为每一种报告基因开发对应的放射性探针,成本较高。限制报告基因示踪技术发展的另外一个关键因素是外源性报告基因相关蛋白的免疫原性会在体内引发较强的免疫排斥反应,此外在体外对免疫细胞进行基因改造的过程也有可能会影响免疫细胞的活性和功能。
免疫PET显像实现了免疫细胞的在体可视化监测,能够有效指导肿瘤的免疫治疗。免疫PET所使用的长半衰期示踪剂一般具有较低的正电子发射概率以及高的有效辐射剂量,以Zr-89为例,Zr-89的正电子发射概率为22.74%,有效辐射剂量为0.53mSv/MBq,而临床常用的F-18的正电子发射概率为96.7%,有效辐射剂量为0.019mSv/MBq。这就使得免疫PET显像的图像质量较低,辐射剂量较高,限制了重复性扫描的开展[4]。
西门子极光PET/CT Biograph Vision Quadra具备106cm最佳长轴距以及200ps量级TOF光子冻结技术,带来40倍临床性能的提升,相比于短轴距和两米轴距的设计,灵敏度和NECR均达到业内最高水平[5]。Biograph Vision Quadra集亚毫米级、全时域、超精细全身显像于一体,使得免疫PET能够实现更低的药物注射剂量、更快的扫描时间、更高的信噪比以及更好的图像分辨率,结合0 CT PET自显像扫描模式,能够更为顺利地开展重复性检测。Quadra使得免疫PET的扫描时间可以从32min降低至3min[2022 EJNMMI, University Medical Center Groningen],相信Quadra的到来,也会进一步助推免疫PET技术的发展。
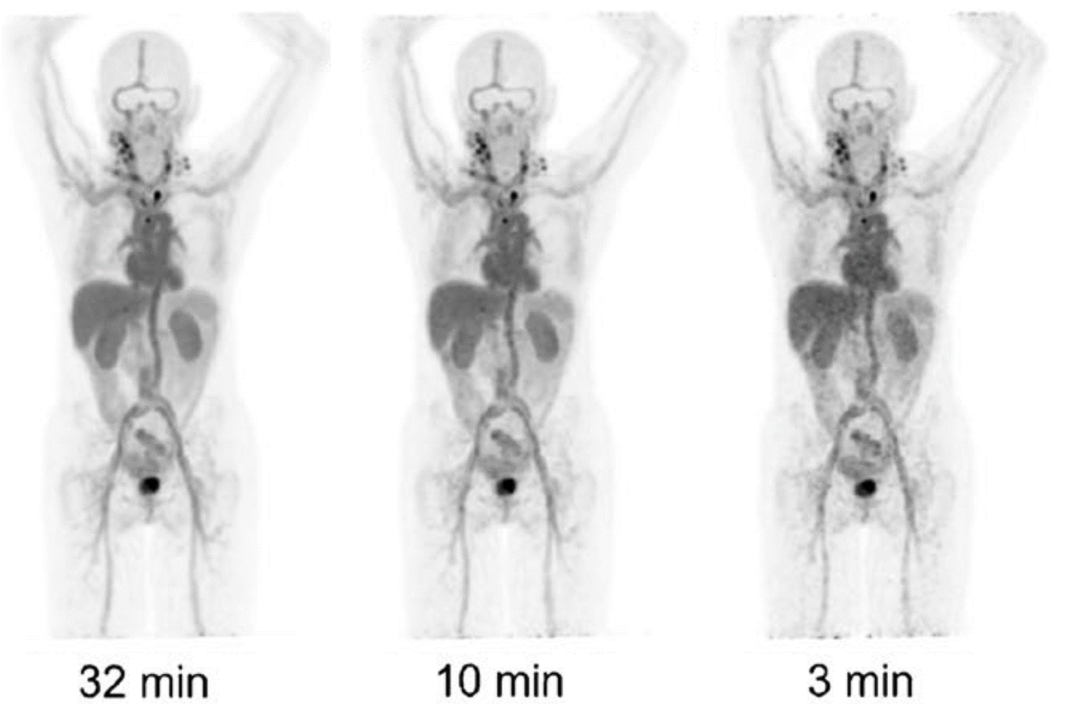
Biograph Vision Quadra 89Zr-trastuzumab PET imaging in breast cancer[6]