在一定程度上,由于其悠久的历史、易于获得以及通常更简单的共轭化学,β-粒子发射器RPT试剂得到了更多FDA批准或非常接近批准(例如 Lutathera (177Lu–DOTATATE)、177Lu-PSMA-617、131I-MIBG)。然而,对αRPT有显着反应的β发射体RPT癌症抵抗的临床例子引起了人们对αRPT的极大兴趣。对体内αRPT的分布进行成像的能力使剂量测定法成为可能,并可使用正常器官或肿瘤吸收剂量估计值2来确定在考虑正常器官辐射耐受限制的同时,可提供最大肿瘤吸收剂量的给药活动1。这是放射性药物治疗采用剂量测定法的主要原理。它的采用有望使αRPT获得更快、更容易的批准,并使患者获得更好的结果。剂量测定法提供了一种较少经验性的方法来评估αRPT疗法相对于其他癌症治疗药物的疗效。有大量出版物证实吸收剂量可预测反应[4–11]。最近在用90Y微球治疗的肝细胞癌患者中进行的Dosisphere-01试验的显著结果提供了严格的令人信服的证据,表明RPT患者治疗不足(以前的五个III期试验已经失败),并且个性化剂量测定改善了患者的预后。根据个性化剂量测定计算,观察到接受给药活动的患者中位总生存期提高了两倍以上(从10.7个月到26.6个月),肿瘤接受205 Gy或更高剂量的患者中位总生存期比肿瘤接受低于205 Gy的患者中位总生存期提高了三倍(7.1个月对26.6个月)[12]。90Y微球疗法的剂量测定比αRPT简单得多,然而这些结果具有相关,因为它们说明了在所有形式的放射性药物治疗中采用剂量测定法的一般原理。如下文所示,实现αRPT的精确剂量测定的确存在重大挑战,但目前被认为困难的事情不应被误认为是不可能实现的,因为成像和剂量测定技术正在快速发展。此外,如Dosisphere试验经验所示,个性化剂量测定驱动的治疗可以显著改善临床结果。这为克服αRPT成像和剂量学的挑战提供了强大的动力。
全身性癌症治疗已经进行了超过75年,但没有对治疗药物在人体内的药代动力学和生物分布进行成像。传统的细胞毒性剂和靶向剂不像RPT那样容易进行成像和剂量测定。在有足够的临床数据提供临床依据之前,不能证明αRPT成像的潜在优势。这种数据不会被收集,因为理由不存在。通过一个基于黑盒类比的启发式论证,然后提供一些例子,有可能打破这个先有鸡还是先有蛋的难题。就其本质而言,启发式论证做出假设并且不严谨,但可以提供克服先有鸡还是先有蛋的问题所需的洞察力和动力。
图1提供了公认的全身性癌症治疗实施过程的总体简化。然而,基本大纲符合目前的做法。共同努力为给定患者或患者群体(输入)确定尽可能最佳的治疗方案。然后通过一系列反应指标(输出)来衡量治疗结果。由于该系统是一个黑箱,确定为什么治疗不起作用、如何改进以及与什么结合的过程涉及提供更多的输入“实例”并将这些与输出进行比较。由于高度的空间和时间异质性[13],最近整合组织样本基因组分析的努力非常容易受到采样不确定性的影响,并且没有兑现其最初的承诺[14]。在黑盒类比的背景下,组织取样类似于在黑盒上戳小孔,以获得其在单个时间点的工作情况。用于确认和监测针对患者选择的目标表达的诊断成像影响输入,并有助于理解黑盒的输入/输出分析方法。在给药后不同时间提供αRPT生物分布的成像方式,特别是核医学,类似于使盒子不那么不透明。根据多种因素(例如,图像的定量准确性、既往患者病史及其对放射敏感性的影响,以及剂量计算方法对αRPT的微尺度分布的解释程度),使用这种图像进行剂量测定可以进一步降低黑盒的不透明度。对于这种过于简化的类比,有很多需要注意的地方。鉴于癌症的显著复杂性,以及肿瘤和正常细胞对治疗剂的复杂反应,有人可能会认为癌症治疗本质上是一种黑盒系统努力。注意到对从具体例子中概括的批评,然而检查具体例子是有益的,其中RPT试剂的成像改善了患者护理,或者至少提供了一些改善结果的步骤的方向。
第一个例子在αRPT之前,但它是相关的,因为它证明了成像如何能够提供对耐药原因的洞察,也证实了克服治疗耐药的联合治疗的作用机制。分化型甲状腺癌(DTC)的放射性碘治疗是第一个也是最成功的全身治疗方法之一。它的起源可以追溯到索尔·赫兹博士关于创造放射性碘的可能性的调查。
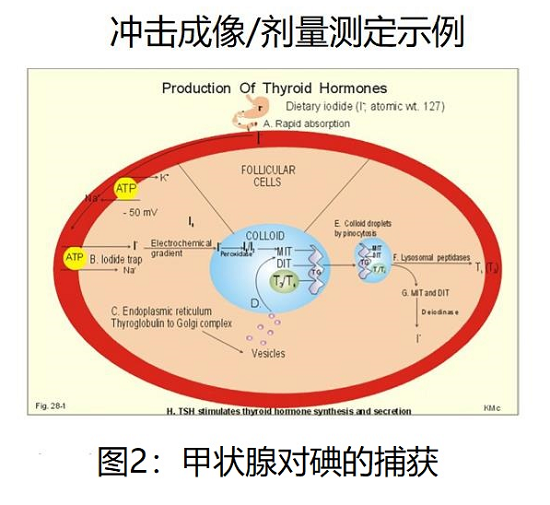
图2描述了说明放射性碘治疗DTC显著疗效的基本机制。口服摄入的碘化物通过胃被吸收到循环中。甲状腺滤泡细胞表面的钠/碘同向转运泵将碘浓缩成密集的胶体[19,20]。Benua和他的同事注意到,如果放射性碘治疗延长很长一段时间,它会变得不那么有效。影像学证明,疗效的丧失是由于甲状腺癌转移中摄取的减少。这些基于成像的临床观察引导他们设计出一种实用的血液和基于放射探针/成像的方案,以给予最大的给药活性(AA ),避免骨髓抑制和放射诱导的肺纤维化[21]。后者是弥漫性肺转移患者的关注点[22,23]。放射性碘靶向性的丧失随后被证明与特定的细胞信号传导途径和碘化钠同向转运体的细胞表面表达减少有关[24,25]。
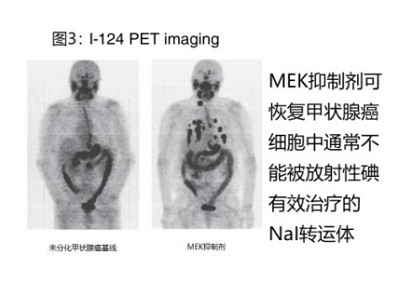
在2013年《新英格兰医学杂志》的一篇文章[26]中,Fagin及其同事证明了在具有BRAF或NRAS突变的转移性甲状腺癌患者中抑制MEK途径会导致放射性碘摄取增加。使用124I PET成像,他们确定了肿瘤符合放射性碘治疗效果的吸收剂量阈值的患者;图3显示了selumetinib (MEK抑制剂)治疗患者前后的PET图像。这种方法的临床试验正在进行中(NCT00970359)。
在最近启动的一项临床试验(NCT04892303)中,目前正在检查剂量测定驱动的放射性碘/外照射联合放射治疗(EBRT)在甲状腺癌患者中的可行性,这些患者的病变剂量测定、放射性碘后治疗低于疗效所需的剂量。该方法建立在以前的工作基础上,使用基于成像的吸收剂量图进行EBRT联合治疗计划[27]。
第二个和第三个例子说明了成像和剂量测定在治疗优化中的作用,特别是RPT剂的给药量如何影响靶向。在设计使用放射性标记的抗CD20抗体治疗B细胞淋巴瘤的治疗方案时,成像是至关重要的。肿瘤-正常组织-吸收剂量比作为抗-CD20抗体mg量的函数,用于达到适当的未标记(“冷”)、治疗前给药[28]。在首过效应中,用冷抗体饱和循环B细胞上快速可接近的外周部位进行预处理,使放射性标记剂具有更好的靶向性。
第二个例子也是αRPT的成像和剂量学的第一个例子。用213Bi标记的抗CD33抗体HuM195 (Lintuzumab)治疗急性髓性白血病(AML)患者。由于对任何一次注射所能达到的比活度的限制,通过增加注射次数以保持比活度恒定来进行AA升级。在2天的48小时疗程中,注射次数从3次到6次不等。在所有患者的第一次和最后一次分次后以及前几名患者的每次分次后对213Bi的生物分布进行成像。由于213Bi的半衰期较短,为45.6分钟,因此在注入αRPT期间开始成像。采集前30分钟的1分钟动态采集数据和后30分钟的3分钟采集数据,以计算骨髓、肝脏和脾脏的吸收剂量[29]。未观察到肾脏摄取,这是该药物的一个关键问题。这些图像随后被转换为参数图像,描述了不同解剖区域的药物摄取或清除率(图4) [30]。
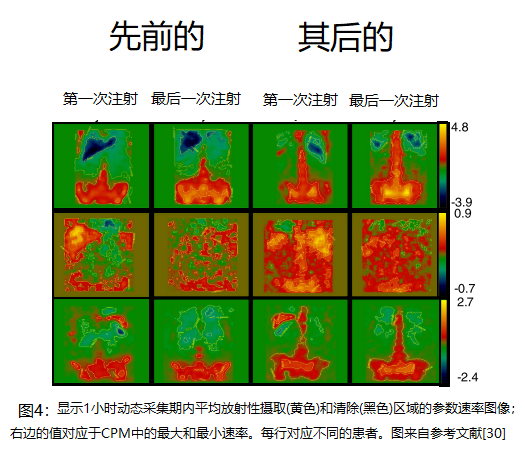
在一些患者中,这些图像和相关分析表明,随着αRPT量的增加,靶向白血病负荷部位(骨髓)的能力逐渐提高。在其他患者中,增加αRPT给药导致血池(即心脏和肝脏)活性增加。为了减少可能与白血病肿瘤负荷相关的靶向可变性并改善靶向性,后续试验包括在αRPT给药前使用环磷酰胺(环磷酰胺)治疗以减少肿瘤负荷[31]。
下一个例子与FDA批准的αRPT 223 racl 2(Xofigo)有关。在这个例子中,随着时间的推移,成像告知了药物的排泄模式,并产生了证实临床前观察的有价值的信息(图5) [32]。
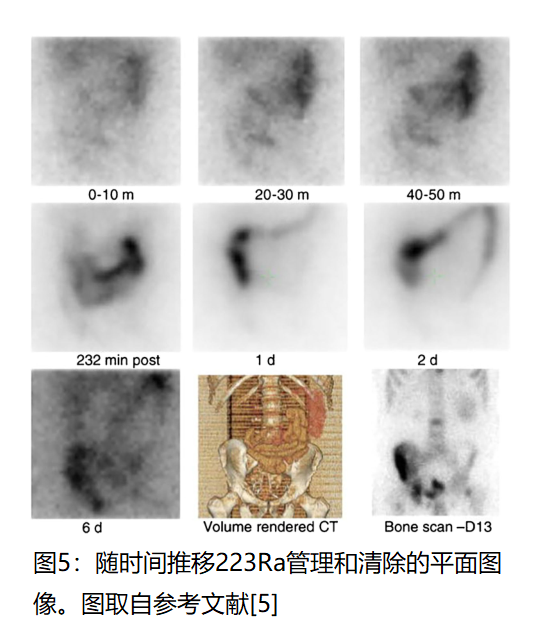
图5的早期动态图像显示药物从循环中非常快速地转移到小肠中,随后通过粪便排泄。注射后10分钟观察到靶向正常和受累骨,并持续到最后收集的成像时间点。在一些但不是所有的临床前研究中观察到了胆汁排泄。患者成像显示,人类的主要排泄途径是通过小肠,而不是肝胆系统。223RaCl2随后与已知影响骨代谢的其他抗前列腺癌药物组合。它们的选择和应用并未受益于影像学评估,例如,这些其他药物增加正常骨中223RaCl2摄取的程度,或它们如何影响排泄。皇家马斯登物理组[33–35]和Yoshida等人[36]从全身平面成像中推导出了吸收剂量估计值和房室模型;基于国际辐射防护委员会(ICRP)参考模型的隔室模型也已用于223Ra剂量测定[37]。已经审查了使用该药物进行基于图像的个性化治疗的潜力[38]。
最后一个例子涉及基于 227Th 的 αRPT。基于钍 227 的 αRPT 正在开发用于许多与癌症相关的目标 [40–43]。227Th (T 1/2 = 18.7 d) 的第一个子代是 223Ra (T1/2 = 11.4 d),如前所述最后一个例子涉及基于 227Th 的 αRPT。基于钍 227 的 αRPT 正在开发用于许多与癌症相关的目标 [40–43]。第227世(T-1/2)的第一个子代 = 18.7 d)为223Ra(T1/2 = 11.4 d),如前所述。子代的命运不再受制于母代。因此,体内产生的223Ra预计将遵循镭盐223RaCl2(Xofigo)的生物分布。图6所示的图像证实了这种情况。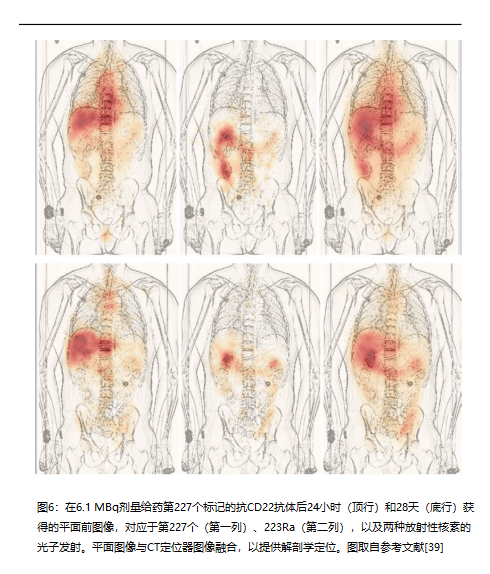
图6的第一列(227能量窗)描绘了抗体结合放射性的预期模式。给药后24小时,肝脏和循环中的活动主导了这种分布。第二栏中的图像对应于第227位的第一个子代223Ra,显示了现在熟悉的肠道排泄模式。这些图像证实,到24小时时,227次衰变产生的223Ra的分布遵循223RaCl2的分布。到28天时,第227个标记的抗体已从循环中清除,并在肝脏和可能在脊柱CD22阳性病变中可见。此类信息对于剂量学建模特别有用,其中,从一级来看,来自抗体共轭227Th的吸收剂量可来自抗体生物分布研究,可能使用替代显像剂,例如89Zr或111In,而来自223Ra的剂量学可来自之前的223Ra特定剂量学研究。
挑战和可能的解决方案
为αRPT试剂提供的所有成像示例都是平面二维图像。如示例所示,二维平面图像可以提供有价值的信息。然而,它们不提供深度信息,也不像3-D(SPECT)成像那样严格量化[44-46]。深度信息特别是对于肿瘤的描绘很重要。αRPT药剂的定量SPECT成像面临的挑战是治疗所需的低给药活性和α粒子发射型放射性核素的光子丰度通常较低的组合。
乍一看,αRPT的成像和剂量学驱动的治疗计划似乎极具挑战性——如果不是不可能的话(表1)。迄今为止执行的αRPT剂量学计算依赖于当前的能力。他们用过平面成像、全组织吸收剂量估计和参考值 RBE(通常为5)。这种估计及其与放射治疗毒性测量的比较在指导剂量递增研究方面具有一定的实用性;它们在个体患者治疗计划中的效用可能会受到适当的质疑,除非另有证明。

然而,在这些挑战中的每一个方面都将取得进展。鉴于所示示例,挑战1 (C1) 的重要性可能并不明显,尽管平面成像被广泛使用并被认为速度更快,但它不提供有关不同深度分布的信息,以一种远非量化严谨的方式例行实施[72, 73]。这是因为使其更加量化需要相当大的努力,包括在进行活动管理之前使用外部均匀(洪水)活动源对患者进行成像以进行衰减校正或收集 CT 扫描 [74]。即便如此,不同患者的空间和活动准确性存在相当大的差异。这导致毒性和反应预测的不确定性。多项研究已经证实,剂量学的可靠活动量化需要 SPECT 成像 [46, 75, 76]。尽管广泛用于非α发射RPT,但SPECT成像尚未用于αRPT。αRPT 中使用的放射性核素通常具有复杂的衰变方案,具有多个子元素以及α、β和光子发射。有许多低丰度光子峰,它们跨越很宽的能量范围(从 keV 到 MeV)。由于α粒子非常有效,因此达到治疗效果或避免毒性所需的给药活性通常非常低,导致光子计数率低,这很难用 SPECT 准确量化(表2)。
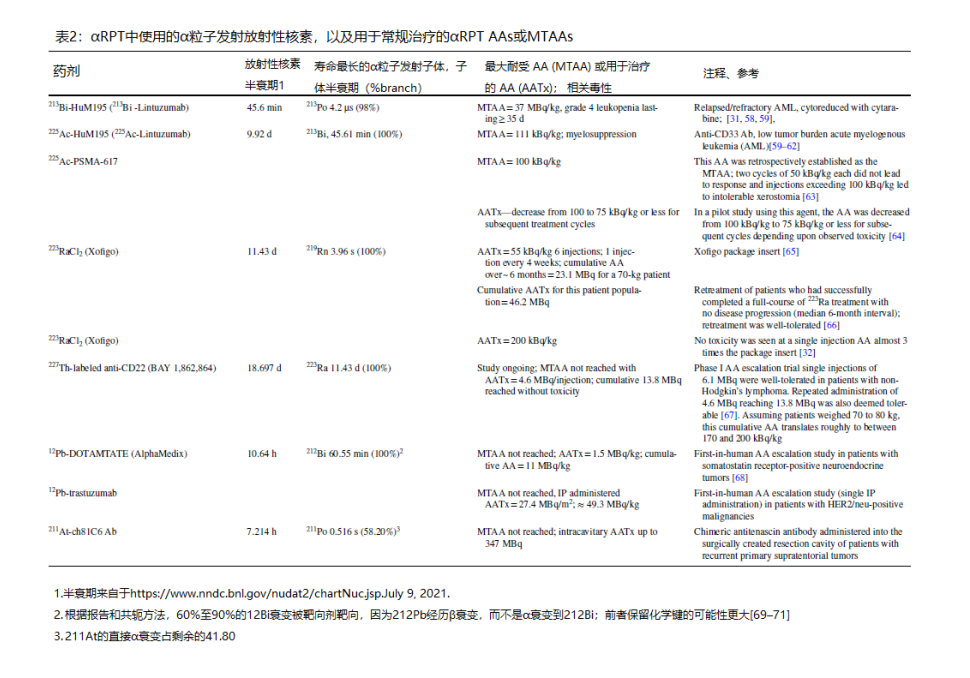
寿命较长的α粒子发射放射性核素也会衰变为子放射性核素,而子放射性核素本身就是α粒子发射体。在某些情况下,子体的半衰期(例如,223Ra的子体为11.4天,227的子体;213Bi的子体为45.6分钟,225Ac的子体)足够长,因此子体不一定会在目标母体衰变的同一地点衰变。为了全面了解此类药物的剂量学,需要同时对目标母体和任何半衰期足以重新分布到其他组织的子代进行成像;了解长寿命的子代的分布对于评估毒性很重要[77]。这一挑战的最初解决方案将是α-发射器。SPECT重建技术正在解决这一问题,以弥补当前SPECT仪器的低灵敏度和低能量分辨率[47–49]。下一代SPECT仪器将解决(5年内)长期和α-发射极无关的解决方案[50,51]。它正在通过SPECT重建技术来解决,该技术可以补偿当前SPECT仪器的低灵敏度和差的能量分辨率 [47-49]。下一代SPECT仪器 [50,51] 将解决 (5年内) 与 α 发射器无关的长期解决方案。
C2的潜在解与c1密切相关。剂量测定驱动的 α rpt的潜在成像选项如图7所示。多个定量SPECT/CT或PET/CT图像是实现精确剂量测定的首选。描述了两种不同的方法。一种依赖于替代显像剂[78–82],另一种依赖于直接成像αRPT的第一部分。使用单时间点技术得出的吸收剂量值[83–85]必须附有其不确定性的估计值,以便明确估计吸收剂量的准确性与单个患者单时间点剂量测定的便利性之间的权衡。在所有情况下,目标都是在剂量测定计算中使用成像信息,其结果将有助于以患者特定的方式调整AA。总体目的是用治疗有效的AA治疗每位患者,该AA不会引起过度毒性。正如放射性碘的经验所表明的那样,如果在长时间内进行治疗,则高效的治疗容易因负责浓缩治疗剂的表型丧失而产生耐药性 [86]。
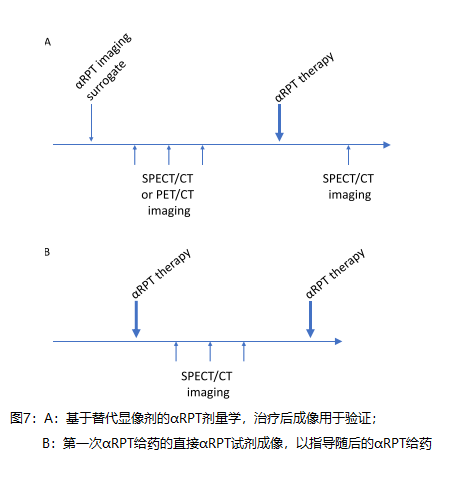
挑战3也与C1和C2密切相关。与β-发射体RPT不同,施用“微量”αRPT是不可行的,因为α粒子非常有效。表2的成像方案是一种选择,但是假设第一次注射是治疗有效的,则肿瘤负荷以及因此的药物动力学和生物分布可能会改变。这可以通过替代物来解决,替代物通过与直接成像比较(见C1解决方案)或通过收集足够的剂量反应数据来验证,以便可以对肿瘤负荷的变化及其影响进行前瞻性建模。很明显,这种方法需要简化,并且需要严格检查相对于成本/后勤的患者结果的潜在益处。
如果目标是能够比较不同药物的吸收剂量,则每种αrpt药剂(C4) 都是必不可少的。这是治疗方式的关键优势,其作用机理是通过DNA损伤辐射诱导的细胞灭菌。另一种选择是具有特定于药物的剂量反应关系,并且可以提供信息,但不一定直接跨药物转化。为C4提供解决方案的基本方法存在 [52,53],但尚未得到充分验证并付诸实践。在将这些技术付诸实践之前,对αrpt试剂进行严格验证的全器官剂量测定仍然有助于为在1期试验中启动AAs提供一般指导。可以比较全器官αrpt估计值的最成熟的剂量反应数据来自外束放射治疗(EBRT) 经验。不幸的是,与αrpt相比,EBRT的能量沉积的时间(剂量率)和空间模式都有很大不同。特别是,空间分布的差异可能导致药物特异性剂量反应的几倍差异。因此,绝对必要的是,第一阶段研究应纳入估计αrpt吸收剂量所需的数据收集,并且升级停止规则应由可测量的毒性驱动,而不是由EBRT获得的吸收剂量限制驱动。这种方法将有可能获得指导未来试验设计所需的αrpt剂量反应关系。然后可以使用宏观到微观工具重新检查这种全器官剂量与反应的关系,以通过更好地考虑吸收剂量的微观分布来建立与EBRT剂量估计的链接。将αrpt I期升级研究限制为AA,从而导致与EBRT毒性限值相对应的吸收剂量值,注定会对αrpt药物的开发和临床实施产生不利影响。对细胞毒性治疗没有这样的限制。对于αrpt这样做会使潜在的优越且被确认为更好的耐受癌症治疗方式处于严重不利地位。
RBE(C5)与剂量反应问题密切相关。RBE最容易在体外使用细胞系和集落形成分析进行测量,其中从参考辐射(通常是X射线)获得的存活曲线与α粒子辐射的细胞存活曲线进行比较(详细综述见参考文献[87,88])。细胞存活曲线也可用于获得αRPT和EBRT中放射性生物效应建模的α/β值。在EBRT中,α/β值也可以根据临床试验结果进行估计[89–91]。类似地,人们可能会设想从αRPT试验中进行临床相关RBE测定,但前提是这些试验需要进行剂量测定所需的数据积累,以便荟萃分析可用于放射性生物效应建模。
挑战6是对所有RPT制剂剂量测定的挑战。吸收剂量应独立于进行成像的物理学家、使用的软件和进行成像的机构。这种标准化对于多中心试验至关重要。一般来说,RPT中标准化和可追溯性的重要性已经得到承认,为应对这一挑战所做的努力正处于不同的完成阶段[56、57、92–98]。
在这些挑战被克服之前,αRPT试剂的常规成像和剂量测定将不会成为现实。克服这些挑战的进展关键取决于一种多学科合作伙伴关系,这种合作伙伴关系认识到通过研究黑匣子对患者护理的潜在好处,而物理学界认识到,在推广这些方法和技术之前,需要改进这些方法和技术。