近年来,嵌合抗原受体T(CAR-T)细胞疗法在血液恶性肿瘤领域中取得了突破性的疗效,而其在实体肿瘤患者中的疗效仍不理想。实体肿瘤细胞表达PD-L1等抑制性分子,与CAR-T细胞表面PD-1结合,致使CAR-T细胞功能受到抑制,这是CAR-T细胞在实体肿瘤患者中疗效不佳的重要原因之一。鉴于此,有研究在CAR-T细胞中共表达靶向PD-L1的嵌合转换型受体(CSR),旨在将PD-L1对CAR-T细胞的抑制信号转换为激活信号,并提升了CAR-T细胞的抗肿瘤活性。然而,PD-L1除表达于实体肿瘤细胞外,且表达于激活CAR-T细胞表面,当前关于靶向PD-L1的CSR反式结合激活后CAR-T细胞表面PD-L1对CAR-T细胞抗肿瘤活性的影响尚不清楚。
科研团队设计了靶向PD-L1的CSR分子CARP,其不含CD3ζ链,因而CARP-T细胞不具有肿瘤杀伤活性。研究在体外和肿瘤人源化小鼠模型中证明了CARP-T细胞能够提升CAR-T细胞的抗肿瘤活性,促进中枢记忆样CAR-T细胞的分化,同时降低CAR-T细胞IL5、IL10和IL13等Th2型细胞因子的分泌。相关机制研究发现,CARP分子能够反式结合激活CAR-T细胞表面的PD-L1,导致CARP-T细胞与CAR-T细胞间发生连接。单细胞RNA测序发现,CARP-T细胞与CAR-T细胞间的连接促进两种细胞间CD70与CD27分子的交流,而CD70-CD27信号通路进一步促进中枢记忆样CAR-T细胞的分化、降低Th2类细胞因子的分泌,最终提升了CAR-T细胞的抗肿瘤活性。此外,研究发现,此类细胞间交流不局限于靶向PD-L1的CSR-T细胞,且靶向CD19的CSR-T细胞同样能够提升共表达CD19分子CAR-T细胞的抗肿瘤活性。研究表明,CSR分子反式结合CAR-T细胞表面靶抗原后可通过CD70-CD27信号通路提升CAR-T细胞的疗效和持久性。目前,该研究处于基础研究阶段。
研究工作得到国家重点研发计划、国家自然科学基金、广东省等的支持。
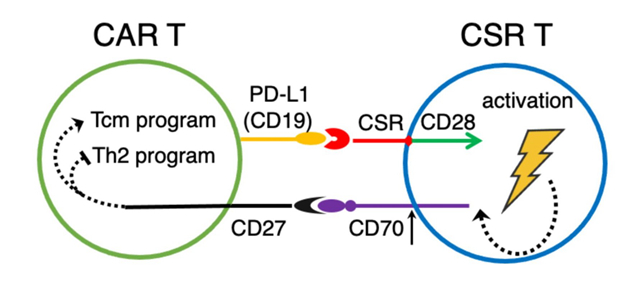
靶向CAR-T细胞表面抗原的CSR-T细胞经CD70-CD27信号通路提升CAR-T细胞抗肿瘤活性概念图