01研究背景
质子重离子束在组织中具有良好的物理和生物特性,在过去数年中,用于肿瘤治疗的质子设备迅速增加。质子与其它放射治疗技术相比的主要优势是其在射程末端沉积了大剂量,即布拉格峰,而在其远端无剂量。因此,定位质子束远侧边缘的精度对于正确的剂量传递非常重要,即确保肿瘤的完全照射并减少对于危及器官的损伤。PET目前是临床上唯一可用的3D、无创、体内监测质子束范围的方法[2],因此在这一结合领域的研究迅速崛起。
采用PET对质子治疗进行射程验证尚有两个挑战:布拉格峰区域低能质子诱发的正电子湮灭辐射信号很低;照射后产生的正电子核素存在生物洗脱。此研究提出采用18O富集水(18-W)作为显像剂的可能性:通过18-W代替常规水渗入活体组织,经质子束照射后产生正电子核素18F,进而行PET/CT成像和质子射程验证。此研究假设18-W可以延缓正电子核素生物洗脱,在活细胞内质子束照射产生的18F将以氟阴离子(F-)的形式被捕获,即使在照射后数小时也可以检测到信号。02研究目的
评估18O富集水(18-W)是否可以将足够的18O结合到活体中,从而在质子照射后产生可检测的18F信号,并且探究照射后细胞内的放射性活度。
03材料与方法
1) 材料:采购商供的含70% 18O的18-W,并以1:9的比例与磷酸盐缓冲液混合。采用头颈部鳞癌细胞(T-HEp3)制备鸡胚绒毛尿囊膜肿瘤模型。
2) 质子照射:采用相同质子束方案照射七个鸡卵(用于体内分析的鸡卵标记为E1–E3,用于体外分析的鸡卵标记为T1–T4)。照射之前,在5分钟内将200μL 18-W缓冲液局部滴加到肿瘤模型表面,以促进其在肿瘤内的吸收。使用机器人平台和激光器将鸡卵与质子束对准(图1)。
其中6个鸡卵(E1-E2,T1-T4)的平均射束强度为6.0±0.5nA。以约2.5*1013质子/cm2的累积通量照射肿瘤,使肿瘤中的总剂量(以100μm的厚度计算)达到2.4×105 Gy。使用相对较低强度的150pA质子束照射另一个卵(E3),传递127Gy的沉积剂量。此研究选择比常规大的照射剂量是为了确保清晰地观察样品中的激活效应,并在较长的时间内测量衰变。
3) 活体PET/CT显像:使用Micro PET/CT监测3个受照射后鸡卵(E1和E2为高剂量照射,E3为低剂量照射)体内产生的放射性活度。低剂量(E3)照射的鸡卵在照射后1小时进行10分钟PET采集,高剂量(E1和E2)照射的鸡卵在照射后3.5-4小时进行9小时PET采集,然后进行CT扫描。
E1和E2的PET数据分为9个连续的60分钟/帧图像进行重建, E3的PET数据重建为10分钟/帧的单个图像。使用3D-OSEM重建,矩阵为225×225×127,体素大小为0.554 mm×0.554mm×0.775 mm。在融合的PET/CT图像上手动分割肿瘤体积,并分别获得E1和E2的肿瘤放射性衰变曲线。然后在计算18F的物理衰变之后,将这些曲线进行指数拟合(考虑到生物洗脱)。
4) 体外分析:使用伽马探测器记录4个受照射鸡卵(T1–T4)内产生的放射性活度,该探测器由CeBr3闪烁晶体组成,呈锥形(底部和顶部直径分别为25和19 mm,高度为19 mm),并与光电倍增管(PMT)耦合。
在照射后10分钟内,切除每个肿瘤,称重,放置在0.5mL微量离心管中,并迅速离心。将离心管置于探测器内,采集29±5分钟,记录样品的放射性活度。然后用PBS轻轻摇晃洗涤样本5分钟,并将肿瘤放入新试管中,快速离心,然后放回探测器。通过这种方式,细胞外基质中的放射性核素与可以通过细胞膜扩散的放射性核素将被洗脱,主要留下被截留在细胞内的放射性核素。另一次采集持续22±13分钟,以确定洗涤后肿瘤中截留的放射性活度。
对探测器记录的伽马事件进行处理,获得511keV峰值(±10%能量窗宽度)内放射性活度的衰减曲线,对衰变曲线(AMEA)进行指数拟合,包括11C、13N和18F的衰变,以获得每个同位素的单独贡献。

图1. 顶部图:此研究的实验方案示意图。首先用18-W滴注鸡卵,然后用8MeV的质子束照射鸡卵,最后用伽玛射线探测器对5个肿瘤进行体外分析,并用PET/CT扫描3个鸡卵。底部图:用外部质子束照射鸡卵的实验装置图。右图中的白色圆圈描绘了肿瘤区域。04结果
1) 活体PET/CT显像:使用PET/CT成像监测3个受照射鸡卵体内的18F活度。在整个实验期间,包括照射和PET/CT采集,鸡胚保持存活。图2a显示了PET/CT融合图像上输送至E1的剂量分布估计。E1、E2和E3的PET/CT融合图像如图2b-d所示。E1和E2的PET图像为第一个小时采集图,E3的PET图像为整个10分钟采集图。PET图像显示受照射肿瘤有高活性信号,而在鸡卵的其余部分或鸡胚中仅观察到少量扩散活性。
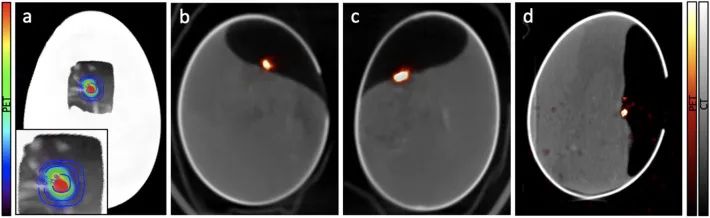
图2. (a) E1的输送剂量、PET/CT融合图像的叠加,图中显示了照射区域的放大图像。照射后E1(b)、E2(c)及E3(d)的PET/CT融合图像。
从E1和E2的9小时长动态PET图像获得的衰减曲线如图3所示。对曲线进行指数拟合(考虑18F物理衰变和生物洗脱),拟合得出的E1和E2的组合半衰期分别为97.6±1.6min和101±8min,生物洗脱半衰期分别为14.7±2.2h和21±18h。一个重要的结果是:18F信号衰减主要由于物理衰变,在数小时内几乎没有观察到生物洗脱,照射后8h 18F活性的生物洗脱低于32%。依据这些结果可以推断:产生的18F离子大部分会滞留在肿瘤细胞内。

图3. 动态PET图像(黑色)和拟合(红色)获得的E1(左)和E2(右)的放射性活度衰减曲线。红色阴影区域表示拟合的95%置信区间。
图4显示了远离目标区域的一些18F活性。此活性对应于照射时细胞外空间(或血管)中存在的18-W。此18F在细胞膜外产生,并通过扩散或循环到达鸡胚的其它区域。此外,一些18F聚集在鸡胚的骨结构中,其实 18F-NaF是一种常用的放射性示踪剂,用于监测成骨活性以检测骨转移。

图4. E1的CT(左)和PET(右)最大密度投影图。CT与PET图像可见骨结构18F摄取(黄色箭头显示高摄取的下颌关节和无摄取的颅腔),以及肿瘤中的18F活性(白色箭头)。
2) 体外分析:照射后切除4个受照射鸡卵(T1-T4)的肿瘤,并用CeBr3探测器进行分析。图5显示了用γ探测器测量的肿瘤放射性活度衰变曲线,以及反映不同同位素贡献的拟合曲线。在用PBS洗涤肿瘤之前,可以观察到大量的18F产生。
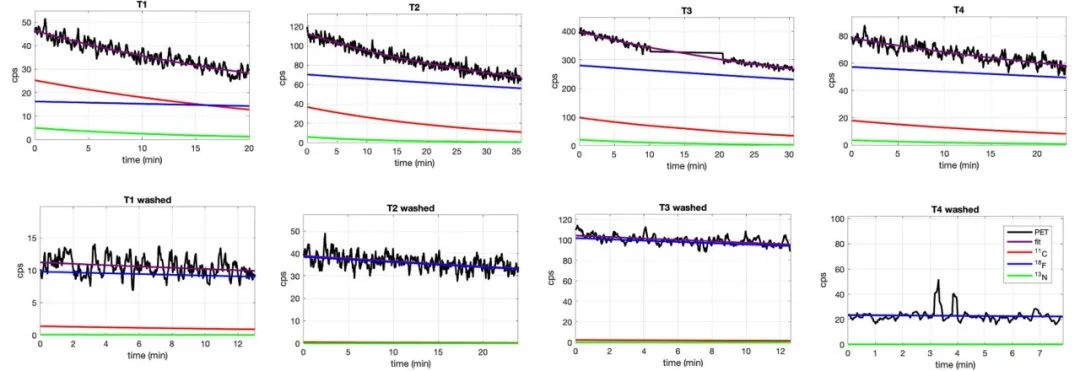
图5. 在用PBS清洗肿瘤之前(上)和之后(右下),用CeBr3检测器记录的T1-T4肿瘤放射性活度衰减曲线(黑色)。对衰减曲线进行指数拟合(紫色),并分别获取以获得11C(红色)、13N(绿色)和18F(蓝色)的贡献。
图6显示肿瘤经清洗后不同放射性核素的残留活度,百分比加权平均值显示18F的残留率为59±9%,显著高于11C和13N的估计残留率(14±26%)。清洗过的肿瘤的测量结果表明:产生的18F大部分仍滞留在肿瘤中,而所有其他同位素都已被清洗或物理衰变。
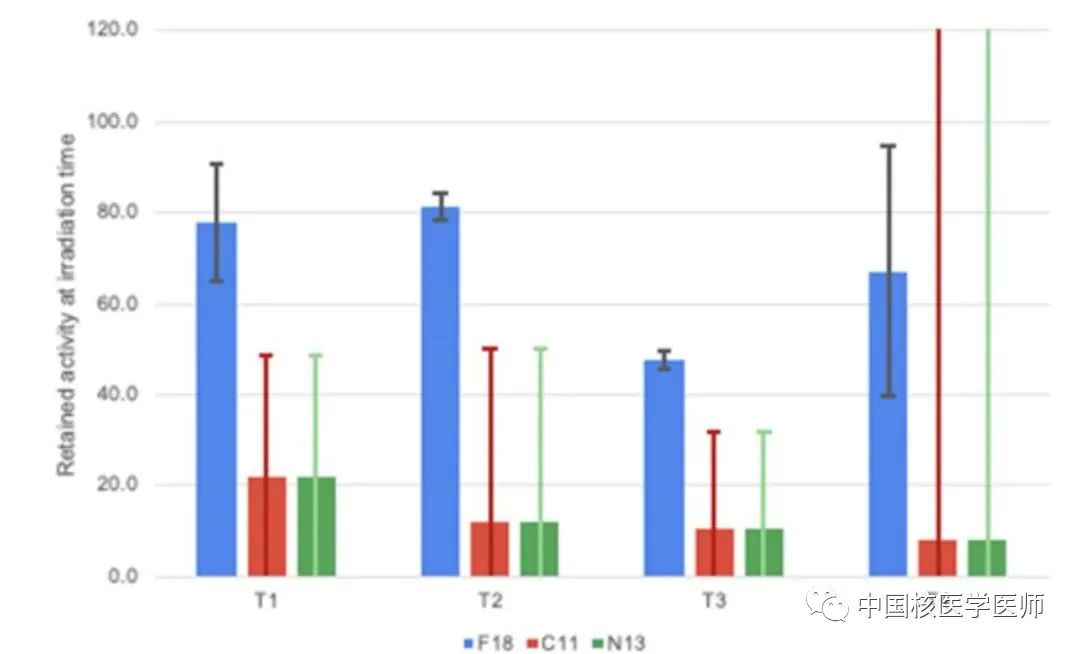
图6. 在用PBS清洗肿瘤之后,T1–T4肿瘤残留活性百分比。
05讨论
Cho等人[3-5]首次提出使用18-W进行质子射程验证,并在模型中测试了其可行性。本研究首次在动物模型中测试了这种方法。质子照射生成18F所需的能量阈值较低(2.6MeV),也就能够在更接近质子射程末端的位置生成18F,从而更精准地验证质子束射程。本研究结果表明,一半以上的18F被截留在肿瘤内,可以满足长时间PET/CT显像。
质子照射18-W后产生的18F能够滞留在肿瘤细胞中,可能是以下原因:水是一种扩散剂,可自由扩散穿过细胞膜。一旦18O转为18F离子,由于其电荷,它不再具有穿过细胞膜的能力,如果在细胞质内产生18F,则会被截留在胞内。尽管细胞中的阴离子通道不是高度特异性的,但对氟离子的渗透性很小。
18-W应用于临床仍有挑战:为了产生足够的18F活性,需要在肿瘤内有高浓度的18-W。在本研究中,将18-W缓冲液直接滴注于肿瘤顶部,这通常可用于鸡卵肿瘤模型给药。对于临床应用,必须探索不同的给药途径和照射方案,以确保肿瘤和周围组织中18-W有较高浓度。18-W比较昂贵,需探索以更低成本获得和使用18O水的技术。06结论
18-W在质子射程的最后一毫米内可产生18F并滞留于肿瘤细胞内,且18F的半衰期较长,可以在照射后2小时以上进行PET/CT扫描。此研究的结果鼓励在更大的动物中进行进一步的体内实验,并使用临床常规的质子束能量来验证和评估18-W作为质子治疗范围验证的可行性。为了在照射体积中获得足够高的18O浓度,还需研究不同的给药途径和照射方案。
由于质子治疗活化的正电子放射性活度很低,通常需要在治疗结束后尽快进行PET/CT显像,以获取足够的PET计数,此外,PET图像需与治疗计划CT精准融合。因此,PET设备需具备足够高的灵敏度和分辨率,才能精确验证质子射程。西门子多款PET/CT设备曾应用于质子治疗后显像研究,目前全新系列的PET/CT随着性能全面提升,优异TOF、高灵敏度和高分辨率使得低活度下的成像质量进一步提高,质子治疗范围的确定更为精准。