
图1:68Ga-NODAGA-SNA006论文截图
v 免疫治疗的探索之路
近年来,免疫治疗方兴未艾,目前已上市的免疫检查点抑制剂适应症已覆盖超过20个瘤种。据估计,只有平均25%的实体瘤患者和40-60%的淋巴瘤患者对当前的抗PD(L)1治疗有反应。出现这一结果的主要原因是“适应性免疫抵抗”(AIR),所以对于AIR的研究至关重要。当前,免疫治疗已经进入了2.0的新时代,未来免疫治疗领域正在向着更加精准的方向发展,我们需要精准的筛选出优势人群,预测免疫治疗的疗效和预后。2022年6月14日,陈列平教授在Nature Reviews Drug Discovery杂志上发表了一篇文章,文章基于肿瘤免疫微环境(TIME)提出了4种不同的类型,以更好地定义免疫状态,预测肿瘤对抗PD(L)1治疗的应答反应或耐药性。
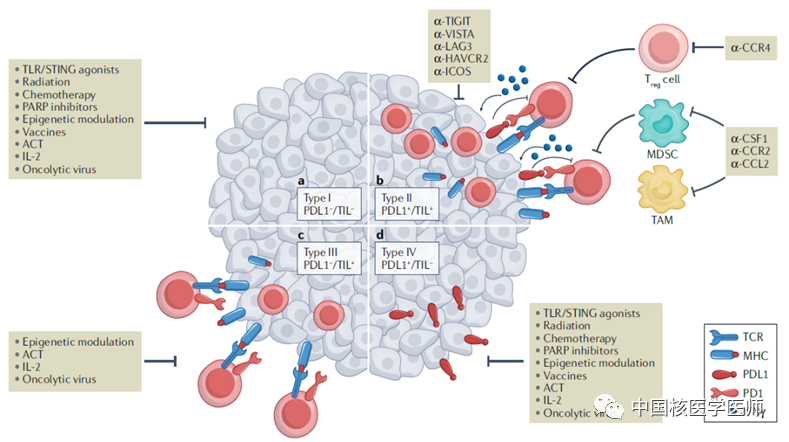
图2 四种不同的肿瘤免疫微环境(TIME):I型:PDL1(−)/TIL(−),II型:PDL1(+)/TIL(+),III型:PDL1(−)/TIL(+),IV型:PDL1(+)/TIL(−)。
如图所示,若既有PDL1表达又有T细胞浸润,则为对PD(L)1治疗有应答的II型肿瘤。然而,肿瘤浸润淋巴细胞(TILs)尤其是CD8+ T细胞,还未被用作预测生物标志物来选择患者。比如IV型肿瘤不存在T细胞浸润,抗PD(L)1治疗也不会产生反应,所以抗PD(L)1治疗的最初耐药不能仅根据PDL1阳性与否来确定,将CD8+ T细胞用作预测生物标志物来选择患者更为重要。肿瘤内PDL1+或CD8+的表达水平具有时空异质性且易受治疗影响。传统临床检测方式为免疫组化,但因局部取样方式和治疗过程等因素,不能全面、精准的反映PDL1+/CD8+T细胞的水平。使用放射性核素标记单域抗体进行体内成像,可避免多次穿刺活检,且能够实时、动态监测全身和肿瘤组织内PDL1+/CD8+T细胞数量的变化,或是未来精准检测的新方法。此外,该检测方式具有明显的临床价值:
1.作为药效指标用在药物临床开发过程中筛选病人,增加药物上市的成功率。
2.上市后为临床医生制定治疗方案提供依据,预测患者能否在免疫治疗中真正获益。
3. 识别免疫不良反应(irAE)。
国际上关于CD8分子显影剂研究火爆,如美国ImaginAb公司的89Zr crefmirlimab berdoxam产品--89Zr标记minibody靶向CD8+T细胞的分子显影剂,在完成Phase I后就与国际多个肿瘤免疫公司和放射性药物公司达成多项合作,涉及领域包括肿瘤疫苗、免疫激动剂、细胞治疗等。苏州智核生物开发的68Ga标记单域抗体相比于ImaginAb的89Zr标记minibody更具有优势,如下图所示:
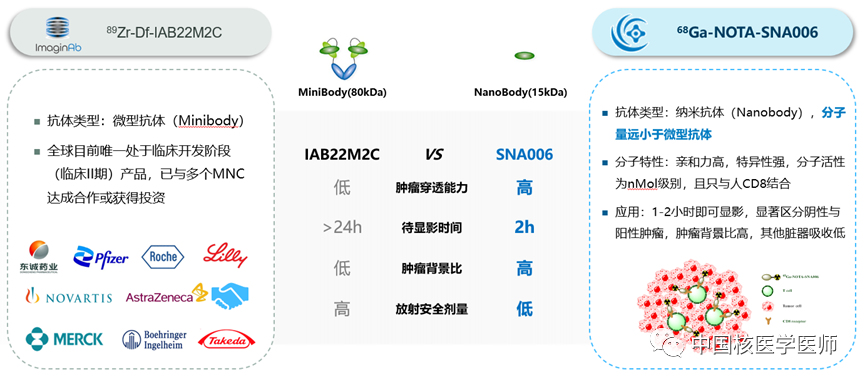
图3 68Ga标记单域抗体与89Zr标记minibody对比图
v 68Ga-NODAGA-SNA006试验数据
苏州智核生物依托单域抗体技术搭建了一系列放射性核素诊疗药物。诊断领域中有首个获得中美IND批准的靶向PD-L1的显影剂(SNA002),之后又研发出另一重磅产品,68Ga标记单域抗体靶向CD8+T细胞的显影剂(SNA006)。为了加快科研成果转化速度,智核生物与苏州大学附属第一医院建立了苏州大学-智核生物放射性药物协同创新中心。研发团队针对SNA006成功的开展了临床前到临床的转化试验,评估了SNA006在啮齿动物肿瘤模型、灵长类动物和肺癌受试者中的首次人体PET/CT显像试验。
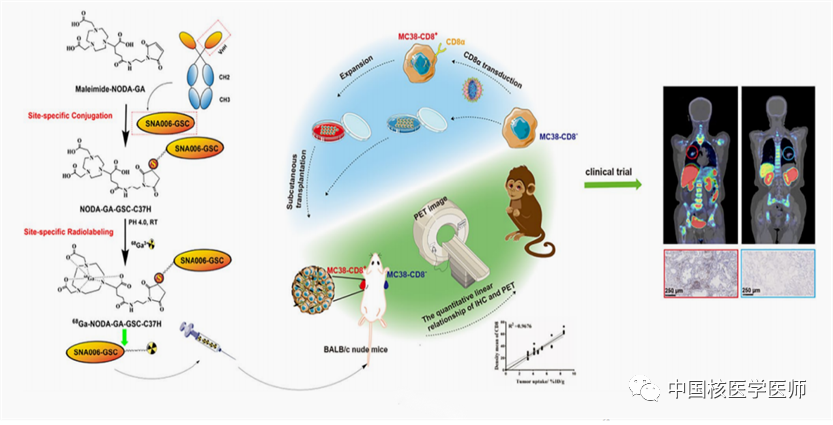
图4 临床转化研究中,使用68Ga标记单域抗体的显影剂对全身CD8+T细胞进行动态定量监测示意图
试验内容及结果如下:
1)注射SNA006 1-2小时后快速显像
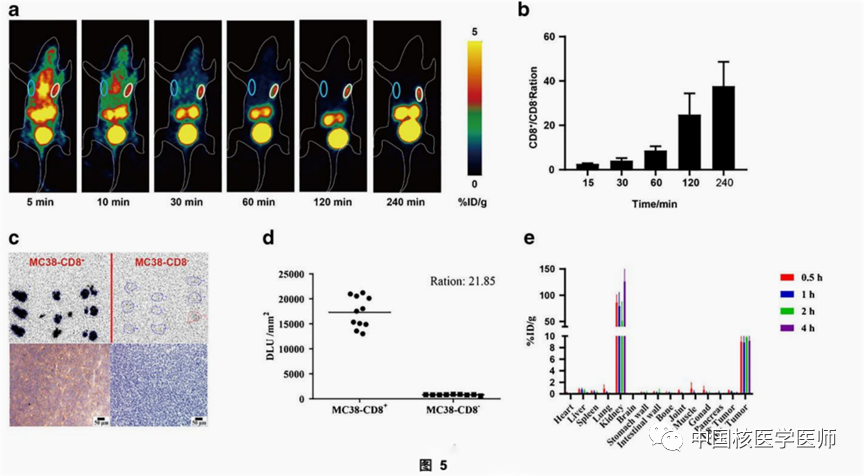
6只异种移植MC38-CD8(−)(左侧)和MC38-CD8(+)(右侧)的小鼠(见图5),经尾静脉注射2.28±0.07 MBq的SNA006,并进行动态PET成像。结果如图5a所示,SNA006静脉注射后在MC38-CD8(+)肿瘤中迅速积累,而在MC38-CD8(−)肿瘤中几乎不可见。随着时间增加,MC38-CD8+/MC38-CD8−肿瘤的摄取量比例逐渐增加。从1小时为9.31±0.27,4小时为42.19±21.54(图5b)。
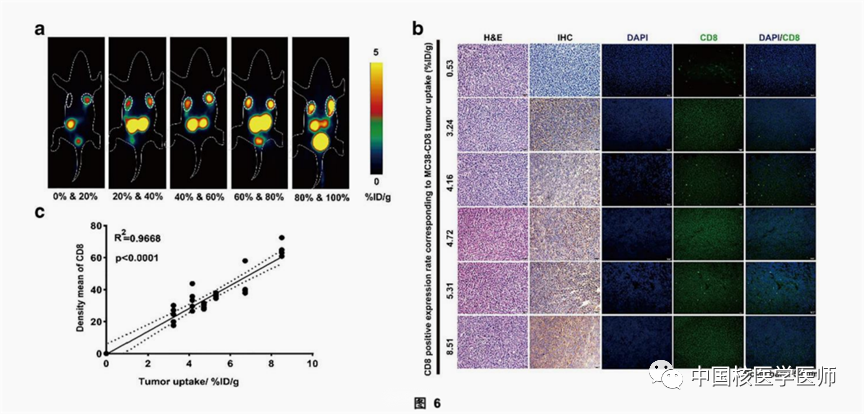
2)SNA006具有高的探针灵敏度和IHC的相关性
图6a显示了SNA006在接种不同比例的MC38-CD8+细胞的肿瘤模型的成像效果,总体趋势是肿瘤中MC38-CD8+的细胞比例越高,肿瘤对SNA006的摄取越明显。进一步的分析显示,SNA006的肿瘤摄取量与肿瘤内CD8表达的平均密度之间存在定量的线性关系(R2=0.9668,P<0.0001)。
3) 有效的靶向性和高度的特异性
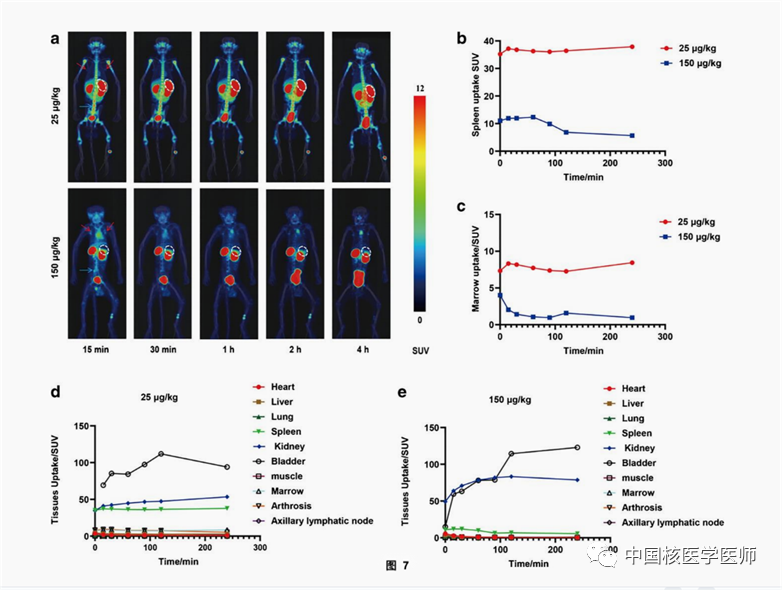
两只食蟹猴均注射了45-55 MBq的SNA006后,其中一只注射25 μg/kg的SNA006,另外一只注射150μg/kg的SNA006,给药后立即进行PET/CT成像。结果显示(图7),SNA006主要保留在CD8丰富的组织中,如脾脏、骨髓和淋巴结,而在CD8贫乏的组织中,如大脑、肺部和肌肉,放射性摄取较低。当SNA006剂量从25μg/kg增加到150μg/kg时,脾脏的浓度减少了90%以上,这说明SNA006在体内可以特异性靶向CD8,且结合能力较佳。
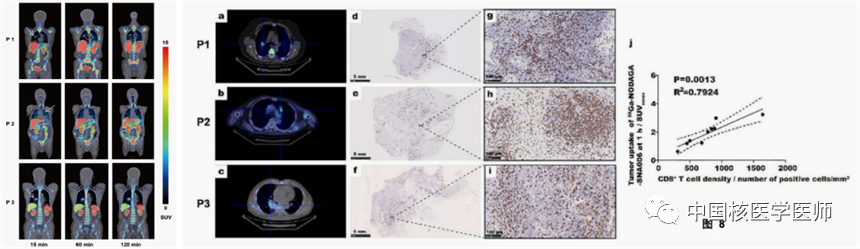
4)首次人体试验数据:安全,高质量显像
在PET成像过程中或注射SNA006后的一周内,受试者没有出现相关不良事件。脾脏显示出最高的放射性积聚,这与临床前结果一致。第三位受试者肿瘤病灶最大,SNA006PET成像有明显的异质性。IHC染色也证实了CD8在肿瘤病变和癌旁组织中的表达的不均一性(如图8 d-i),这表明SNA006 PET成像对于量化CD8的表达具有很高的敏感性。
展望
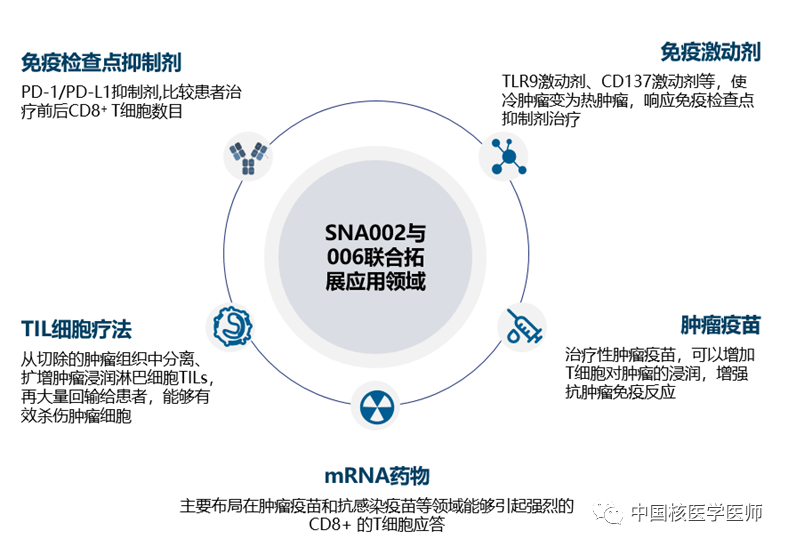
在全球肿瘤免疫治疗火热的大背景下,有越来越多的循证证据表明CD8+T细胞是预测患者对免疫治疗应答反应重要的生物标志物。更为重要的是,由于CD8+T细胞的表达异质性特点及临床实际中需多次穿刺活检取样的痛点问题,这种无创式的放射性核素显影剂的临床意义变得愈发重要,更能满足临床患者真正需求。此外,CD8+T细胞显影剂可应用的领域如下图所示:
近两年,国内核药企业研发投入增长强劲,核药赛道受到越来越多的临床核医学专家及肿瘤免疫专家的关注。此项研究数据的发布预示着未来会有更多临床专家和药企进行合作探索。有专家表示:免疫治疗已逐渐成为继化疗、靶向治疗后更加主流的治疗方式,传统免疫组化方式虽为金标准,但弊端明显,如有创取样、仅检测局部肿瘤组织等问题,亟需能够解决上述问题的新型检测手段。上述数据的公布给予了临床一定的数据参考,初步显示了PET/CT显影方式的临床可行性,相信未来会有更多的临床专家进行更加深入的探索。此外,我们非常期待该产品能够尽快推至临床I-III期试验,造福更多的患者。

关于苏州大学-智核生物放射性药物协同创新中心
苏州大学—智核生物放射性药物协同创新中心于2020年成立,依托苏州大学以及苏州大学附属第一医院临床药学团队和核医学科。苏州大学附属第一医院临床药学团队在缪丽燕教授带领下,深入开展创新药临床研究与转化,在临床试验中融入药物基因组学、PK/PD建模等技术,并率先在国内应用同位素14C标记小分子药物,开展新药物质平衡研究,以及正电子核素(68Ga、89Zr、18F等)/单光子核素(125I、131I、177Lu等)标记放射性药物的分子影像研究,依托“十三五”国家新药创制重大专项支持,目前已建成了以同位素示踪为特色技术的新药创制研究与转化平台,为新药高效研发提供有力的临床支持。协同创新中心作为校企间重要的科技创新平台,旨在加快科研成果转化速度,提升产业科技创新水平,致力于放射性同位素标记单域抗体的分子影像研究,为肿瘤诊断和治疗提供精准解决方案。
关于SNA006
SNA006为智核生物自主研发的以68Ga标记单域抗体靶向CD8+T细胞的显影剂,也是国内首个获得临床数据的放射性核素显影剂。SNA006只与人T细胞的CD8受体特异性结合,1-2小时即可获得全身靶病灶内CD8+ T细胞的正电子发射断层扫描(PET)成像结果。SNA006结合PET/CT是打破传统有创式的免疫组化方式监测CD8+T细胞的创新型诊断方法。目前苏州大学附属第一医院缪丽燕团队发起的IIT试验已完成。相关研究发表在多篇高质量、高影响因子的学术期刊J Nanobiotechnol和EJNMMI上。
关于智核生物
苏州智核生物成立于2015年,是一家以“用最具创新性的核医学诊疗产品,给患者带新的希望”为使命的核医药公司,致力于为全球患者提供创新性的放射性核素诊疗药物。智核生物创建了具有自主知识产权的基于单域抗体的放射性药物发现、研发、生产技术平台,并建设了近万平的抗体偶联放射性药物GMP车间(乙级资质)。公司前瞻性的布局了一系列专业化、高质量的放射性药物研发管线,涵盖10多个创新核素诊断和治疗产品。首个针对甲状腺癌放射性碘治疗的重组人促甲状腺激素(SNA001)已递交新药上市申请并获得受理,将填补中国大陆用药空白;多个创新的针对肿瘤的放射性显影药物已经逐步进入临床,其中首个自主研发的靶向PD-L1的放射性核素标记的显影剂(SNA002)已获得中美临床试验申请批准。