肾上腺皮质癌(ACC)是一种不常见的恶性肿瘤,年发病率为1.5-2个/百万人,IV期患者中位生存期(OS)不到12个月。钇90(Y90)树脂微球选择性内放疗(SIRT)在国际上用于原发性肝癌和转移性肝癌的治疗已超过20年,获得NCCN、ESMO、NICE等国际权威指南的推荐。2021年,美国南佛罗里达大学报道了一名SIRT+化疗用于ACC肝转移患者,接受SIRT治疗后7个月,成功实施肝切除术,切缘病理学阴性,肝无复发时间达16个月,SIRT治疗后的OS超过23个月。
病例描述
58岁男性患者,因疲劳和左上腹疼痛就诊,初诊CT显示:左侧腹膜后15×9×9 cm肿块,胃部肿块直径3 cm。腹膜后肿块活检结果为ACC。随后患者接受了左侧肾上腺切除术和胃部分切除术,病理学提示为ACC和胃间质瘤(GIST)。手术后患者服用米托坦2.5年,并接受肾上腺瘤床辅助放疗。
左肾上腺肿块。a. CT平扫显示左肾上腺异常肿块(箭头),胃部3cm肿块(星号);b. 增强CT显示左肾上13.8×9.8×9.4 cm肿块,大部分坏死,存在散在强化和中央区低密度,病理提示ACC
患者在术后接受定期随访,前4年影像学检查均为阴性。术后第6年的影像学提示右肝叶 9.5×8.7 cm肿块,疑为转移性病灶。因外科医生发现肝脏表面弥漫性斑块状病灶而暂未行右肝切除,故先行肝5段小结节切除术和胆囊切除术。
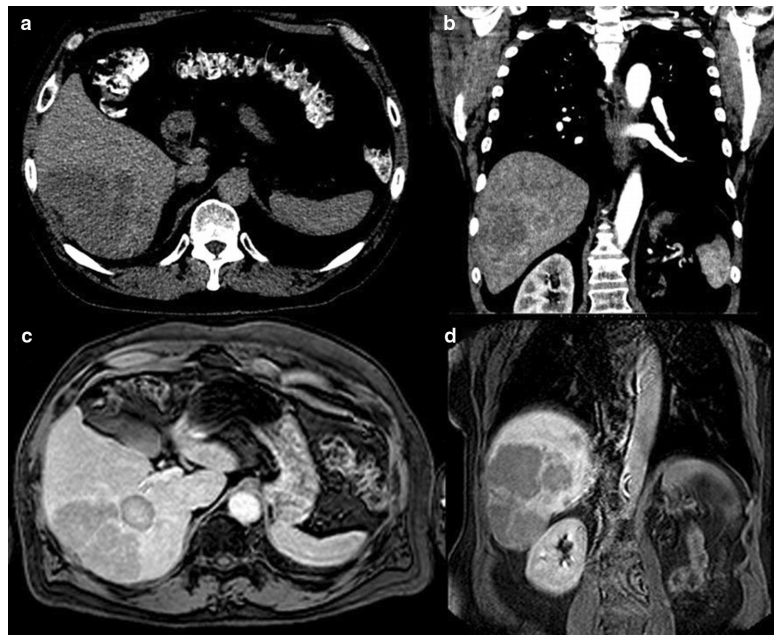
ACC肝转移。a. 初诊后6年,CT平扫肝右叶肝5、6段低密度9.5×8.7cm肿块;b. 增强CT显示周围强化,中心坏死,疑似转移性病灶;c. 增强MRI的T1抑脂序列显示肝右叶多处环形强化病变;d. 手术切除1个月后,增强MRI的T1抑脂序列显示肝右叶肿块增大
手术后,经多学科委员会讨论,决定行全身化疗+肝定向治疗。患者开始EDP方案(依托泊苷、阿霉素和顺铂)化疗。而后患者接受Y90树脂微球治疗,基于改良的体表面积法(BSA)计算的给药活度为1.8 GBq,考虑到可能存在肿瘤放疗抵抗,计划给药活度2 GBq,预估肿瘤吸收剂量为105 Gy,正常肝吸收剂量为26 Gy,肺分流为3 Gy。经肝动脉输注Y90树脂微球之前,栓塞供应肿瘤血流的侧支血管右膈下动脉分支以防止分流。实际给药活度为2.11 GBq。
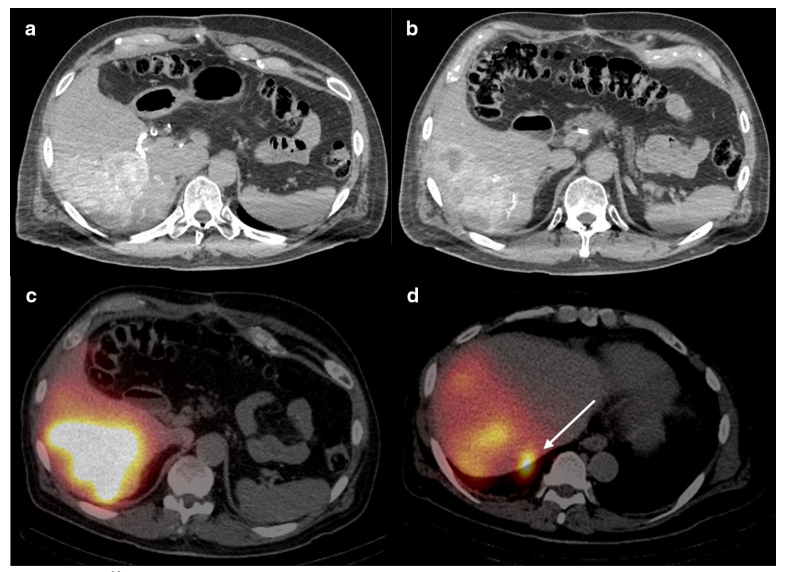
SIRT治疗前的影像。a. 增强CT动脉期显示肝右叶高强化病灶伴 b. 肝下部低强化病灶,可能由右膈下动脉分支供血;c. 右肝动脉注射99mTc-MAA后,SPECT/CT图像显示,右肝叶肿瘤大部分具有强烈的活性,周围区域低信号,与3D CT血管造影中所见的低强化区域基本一致;d. SPECT/CT图像还显示沿肝7段后表面(箭头)有强烈的局灶性活性区域,表示浆膜下层肝转移,这可能与初次手术时所见的斑块样病变相对应
患者术后在康复室发生肾上腺危象,表现为腹痛、出汗,给予地塞米松(20 mg)和氢化可的松(60 mg,q6h),入院并接受类固醇治疗,患者于术后第3天出院,病情稳定。
SIRT治疗后1个月,患者右肝叶转移灶和肝脏表面小病灶直径减小,无新发病灶。3个月后 PET/CT 显示无残留病灶和复发病灶。4-5个月病灶持续性缩小。患者要求行右肝切除术,于SIRT后7个月接受右肝部分切除术,病理学显示切缘无存活肿瘤。
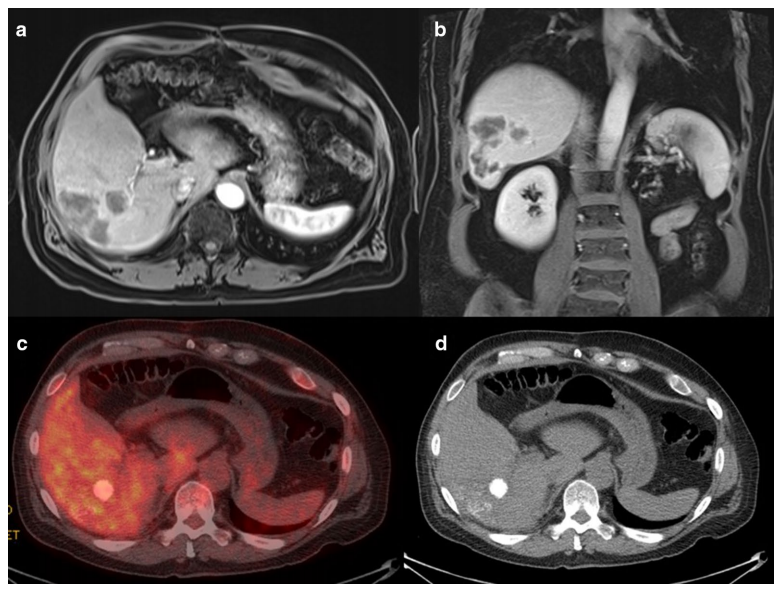
SIRT治疗后1个月和3个月应答。a,b. 治疗后1个月,增强MRI动脉期T1抑脂序列显示右肝病灶缩小,未见异常强化;c,d. 治疗后3个月PET/CT显示右肝肿瘤瘤床无残余活性病灶
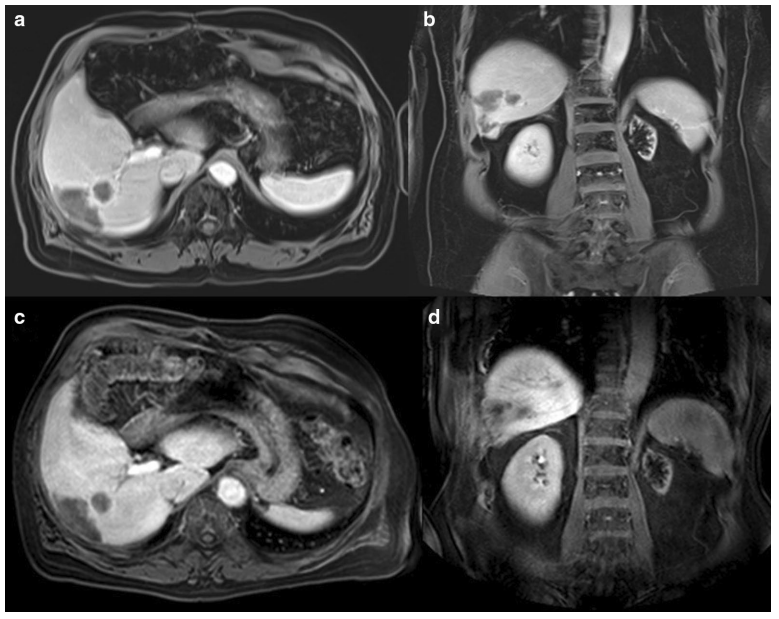
SIRT后4-5个月持续应答。a,b. 治疗后4个月门脉期MRI的T1抑脂序列和 c,d. 治疗后5个月提示右肝病灶持续性缩小
患者右肝部分切除术后定期随访,因既往不良反应拒绝米托坦辅助治疗。术后1个月影像学未见肝脏残留病灶。肝切除术后8个月随访发现门脉周围淋巴结,短径为1cm,病理证实为转移性ACC。患者在肝切除术后肝无复发时间达16个月。
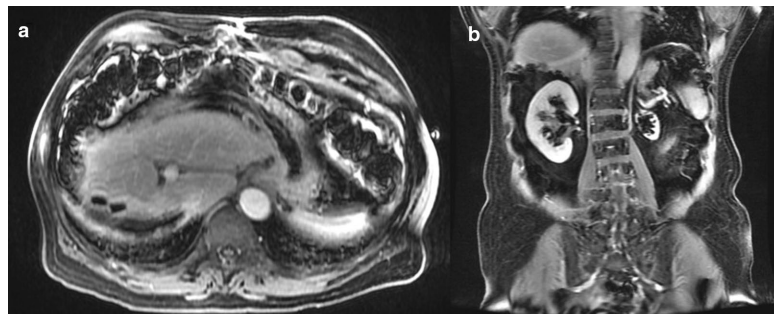
右肝部分切除术后1个月MRI。增强MRI门脉期 a 轴位和 b 冠状位T1加权图像表明从右肝切除缘的手术夹可见线状伪影。病理学未发现存活的肿瘤
既往SIRT在ACC肝转移中已有应用。然而,该病例是首例SIRT+化疗用于ACC肝转移,且成功实现转化切除,手术切缘阴性的病例报道。该例患者在肝切除术后8个月出现门脉周围淋巴结,为ACC复发,可能是由于肝切除术后未行辅助治疗。在肝切除术后16个月无肝复发,SIRT后的OS>23个月,远超过既往晚期ACC的生存数据。该例患者在SIRT治疗后发生肾上腺危象,经对症治疗后好转。这提示对于ACC肝转移的患者,须密切关注其在SIRT术中和术后的状态,一旦发现肾上腺危象的发生,及时对症处理。