影像学
在线自适应计划需要患者的实时影像,主要包括应用室内影像、CT、CBCT和MRI引导的自适应质子治疗以及体内射程验证的最新进展。
CT
室内影像可以通过每日计划或重新计划实现自适应。目前,配备容积成像系统的质子或离子治疗中心均配备了CT或CBCT。由于治疗机头处的尺寸和空间要求,CT系统通常不能提供等中心成像。PSI开发的首批系统使用了患者对接台,可以通过手推车在CT和治疗床之间移动。在NIRS开发的另一套早期系统使用水平CT,环绕在坐着的患者四周。尽管该设备有较大空隙,仍可用于治疗。目前,CT通常放置在治疗室中,患者依靠在轨CT和患者定位机器人完成影像拍摄。与CBCT相比,室内CT在自适应治疗方面有着诸多实际优势,如更高的HU准确性,更好的图像对比度和4D扫描能力。室内CT的缺点是需要较大空间的治疗室,患者必须在显像位和治疗位之间移动。尽管CT影像可以辅以X射线成像或等中心表面成像,但实时成像和束流之间的间隙增加了患者在治疗前靶区移动的风险。
CBCT
质子治疗的CBCT系统可以安装在机架、机头、治疗室里或治疗床上。在机架和机头处安装最适合完成治疗位置成像。影响自适应计划的主要特征是视窗和HU值的准确性。CBCT影像的普及使剂量计算越来越准确。对于光子自适应治疗,基于CBCT的剂量计算通常被认为是可以接受的精度,可应用于商业。质子治疗中CBCT的剂量计算仍被视为一项科研课题,最佳的HU矫正方法仍存在争议。广义上讲,有两类算法,分别为投影空间法和图像空间法。投影空间法是指在X射线投影图像进行体素重建前去除图像中的散射,而图像空间法是指在X射线投影图像重建后提高体素的HU数值。
投影空间法将投影图像建模为主图像和散射图像分量的组合,并试图估算散射分量或主分量。均匀散射估算患者质子剂量时不够准确,需要更先进的方法。从概念上来说,一种简单估算散射的方法是在X射线和患者之间使用一个束流垫板进行测量。图像中束流被阻挡的区域不包含主信号,因此只包含散射。利用类似原理,可调节束流强度而不用完全阻挡束流。目前,已经提出了各种形式的静止和移动束流垫板。据我们所知,暂无任何研究评估质子剂量计算技术,但±15 HU的RMS精度已经有报道。
另外,散射或主分量可以通过算法通过未阻挡图像测算出来。Niu等人介绍了使用之前获得患者CT图像的方法。事先CT与重构CBCT进行变形配准,然后创建用于估算每个投影的主图像。主分量估算从投影图像中用低通滤波器去除错误配准或解剖变化的影响,进而从投影中产生散射估算。研究发现,该方法可将质子计划的射程偏差降低到1.8%~3.6%。研究者可以使用重构CBCT而非注册CT通过射线追踪来估算原始衰减。然而,这种方法需要在射线追踪之前对不正确的HU进行基于图像的校正。目前,该方法已独立验证在模体中产生的射程偏差小于5毫米。
第三大类基于投影的校正方法模型建立在物理基础上或深度学习的集合。最精确的物理校正方法是使用蒙特卡洛来估算和消除散射。重建CBCT图像,然后用蒙特卡洛模拟对投影进行校正。如果重构速度较快,这个过程可以迭代执行。另外,可以使用2D或3D估算散射核的散射分量。在3D中,单一散射模型可以与射线追踪和预计算内核结合使用。2D避免了射线追踪,可从投影图像强度推断出空间变化的散射核。最近,深度学习散射校正变得很流行(图3)。为了产生训练集数据,使用蒙特卡洛方法通过网络将CT体积映射为散射分量。与自由散射训练集对监督学习技术分类的准确性相比,用这种方法计算的治疗计划平均达到2%/2 mm伽马的通配率,超过了98%自由散射。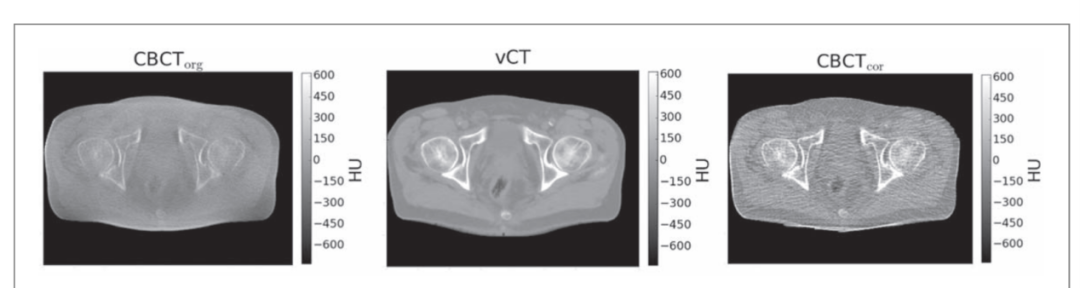
图3. 未校正CBCT(左)HU误差较大不适合计算质子剂量,通过使计划CT变形以匹配CBCT(中间),或重建前去除CBCT投影图像的散射(右边)来校正
与投影空间法相比,图像空间法试图从重建图像中校正HU。普遍采用可变形图像配准(DIR)将患者之前获得的诊断CT映射到日常CBCT上,并直接使用扭曲CT(通常称为虚拟CT、vCT或合成CT、sCT)。经观察,该方法效果略逊于先前的CT散射校正法,可能是由于配准精度或与组织变形无关的解剖变化。另一种方法是利用组织分割分类体素来定位脂肪和肌肉。通过为组织类型分配这些区域和预期HU,可以去除低频散射引起的强度变化。机器学习可用于图像空间校正。在传统的架构中,需要对CT和CBCT图像进行配对。可以通过图像配准来创建变形CT,或通过使用另一种方法校正的图像来训练网络。另一种选择是使用Cycle-GAN架构消除配准需要。
磁共振成像(MRI)
在光子治疗中,磁共振成像已成为一种常用的在线自适应成像方式。磁共振与质子治疗的融合面临的挑战有磁共振扫描仪磁场对质子剂量的干扰、束流和扫描系统磁体对图像质量的影响、磁共振成像的剂量计算以及系统集成。由磁场引起的剂量变化很大,但可以用蒙特卡洛很好地模拟出来。笔形束的横向偏转随束流能量和磁场强度的增加而增加,在0.5 T的磁体中,90 MeV束流的偏转为1.2 mm,在1.5 T的磁体中,200 MeV束流的偏转为28.0 mm。这种效应的精确模型需要成像场和边缘场的磁场信息。由于二次电子能量较低,因此对其产生的影响也较小。又因合成CT结构的不确定性,对质子束MR的剂量计算比光子束更具挑战性。然而,部分迹象表明,在某些治疗点位,剂量差异可能低至几个百分点。设备设计仍然是极具挑战性的难题。封闭孔磁铁和机器人患者定位都很难实现,而且可能需要广泛的磁屏蔽区域,包括旋转机架和扫描系统。核磁共振引导质子束的初步研究最近在OncoRay上有所展示。可以预见,在不久的将来,MR引导质子机器的发展将会加速,这将会对自适应质子治疗技术产生重大影响。
体内射程成像
除了剂量计算的解剖影像,射程验证对于高质量的自适应计划也非常重要。目前,已经提出并使用的有质子射线成像和断层成像、正电子成像以及瞬发伽马成像。 质子射线成像是一种利用高能质子束测量质子穿过物体时能量损失的透射成像技术,它既可用于二维成像技术,也可用于层析三维重建。质子射线成像是由Cormack在1963年首次提出,并于2004年首次用于动物成像。到目前为止,该技术还没有用于人体研究,仍然存在一些挑战。大多数的质子成像使用非常低的剂量率,这使得单个质子可以被跟踪。在质子束离开患者时,可以使用各种探测器测量质子的位置和剩余能量,如闪烁体探测器、GEM气体室或固体器件。射程望远镜可测量质子能量,通过在质子束和患者之间增加一个额外的探测器,可以更精确地跟踪每个质子的路径。另一种方法是使用调能质子宽束。这种方法的优点是不需要射程望远镜,患者的照射剂量更高。质子在患者体内的多次库仑散射导致质子偏离原来的直线路径,从而导致其位置空间分辨率降低。使用反卷积或最可能路径可以在一定程度上减轻这种影响。
正电子成像探测放疗过程中从体内产生的短寿命放射性同位素产生的正电子衰变(图4)。1997年首次将正电子成像技术应用到人体,德国GSI在重离子放疗过程中使用在线PET监测人体。质子放疗中最感兴趣的核素是O-15和C-11,两者的半衰期分别是2分钟和20分钟。这些同位素衰变会发出正电子,最终产生511 keV的湮灭光子。这些核素具有相对较长的半衰期,为开发在线或离线的PET成像提供了条件。在线成像由于能够跟放疗前影像更好地配准以及快速捕获短寿命核素而更具优势,但是该技术受限于空间大小而发展受阻。使用PET进行自适应治疗有几个挑战,首先,PET的成像信号与剂量没有直接关系,因为同位素由核反应产生,核反应的横截面与产生很大一部分剂量的电磁反应不同,因此该技术作为一种治疗验证工具,它比剂量重建更有用;此外,由于正电子穿行、光子非共线性、晶体内部相互作用的深度和其他影响,PET的分辨率通常限制在3~4毫米;另一个挑战是生物性冲洗,即同位素在衰变前会在血管中传播一定的距离。然而,PET在检测到结果与治疗计划发生较大偏离时仍然是一种可行方法。

图4. PET间接质子剂量成像(左)和使用瞬发伽马成像技术验证质子射程(右)
瞬发伽马射线是在非弹性散射事件中从原子核激发态发射出的伽马射线。这种发射并非即刻的,而是在几个纳秒时间范围内,与PET成像一样,瞬发伽马与剂量和射程都有相关性,会伴随有几个高能光子释放,能量大小跟核素相关。由于它并不像PET发出偶合光子,瞬发伽马的测量并不会定位到事件发生的具体位置,但是会提供质子射程的有用信息。第一例用于人体的瞬发伽马成像是Dresden在2015年使用狭缝相机。狭缝相机设计成与束流方向呈90°夹角的位置放置像素闪烁体,并且使用一维狭缝进行准直。测量结果通过分析一维线轮廓的计数统计得到束流射程信息。其他方法包括时间能量分辨的瞬发伽马谱仪、瞬发伽马时间测量和康普顿相机。大多数情况下,预计的发射模式通过蒙特卡洛模拟计算得到,然后与测量结果相比较。虽然通过瞬发伽马不太可能得到三维信息,但是可以得到亚毫米的空间位置分辨精度。