光疗技术如光动力疗法疗法(PDT)和光热疗法(PTT)因其具有微创性的优点等在癌症治疗技术引起了广泛关注。然而,传统的 PDT/PTT 试剂通常存在着成像效率低和无成像能力的缺点。近年来,金属纳米粒子偶联物被证明具有一种新型的聚集诱导发射,使其成为具有吸引力的多功能治疗剂。在这里,该研究设计了单光子和双光子激发荧光,单线态氧(1O2)产生和光热效应的Ce6共轭金纳米颗粒(AuNPs)。Ce6-Au NPs的光活性在单独形式下受到抑制,在聚集形式下显著增强,并且由于发射寿命缩短而显著改善了光稳定性。通过在癌细胞内形成聚集体,利用聚集的 Ce6-Au NPs分别在红外和近红外光的单光子和双光子激发下作为荧光成像探针。聚集的 Ce6-Au NPs还表现出优异的PDT 和PTT 性能,并且能够通过使用功率密度低于皮肤耐受阈值的红光连续波激光有效地根除癌细胞。这种等离子体纳米系统为成像引导的 PDT/PTT 协同治疗提供了一个有前途的潜力,可能为探索安全、无创的治疗开辟一个新的场所。
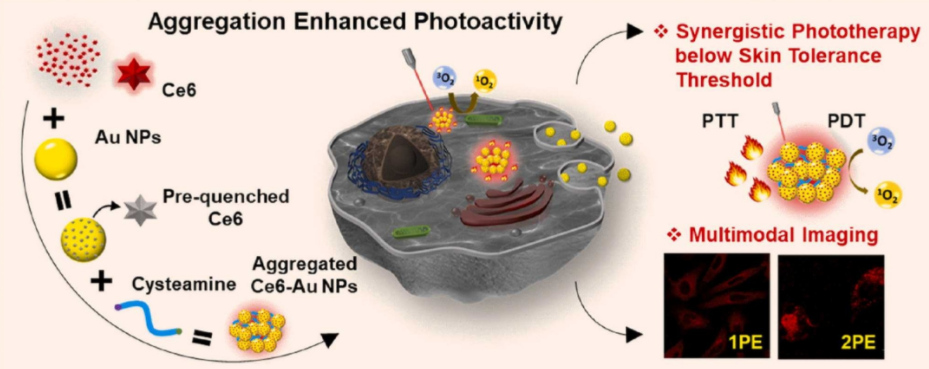
图1. 聚集诱导等离子体增强荧光及抗肿瘤研究
Ce6分子可以通过配位作用紧密吸附在金纳米粒子的表面上。聚集态Ce6-Au NPs的 LSPR 谱带与 Ce6的吸收光谱和荧光光谱有重叠。当与Ce6结合时,Au NPs的LSPR 带略有红移。通过 DTT 置换将吸附的 Ce6分子从Au NP分离并根据 Au NP 和分离的 Ce6分子的消光度计算它们的摩尔比来确定在 Au NP 表面上吸附的Ce6分子的量。吸附在金纳米粒子表面的 Ce6的相应荧光猝灭了约89%。
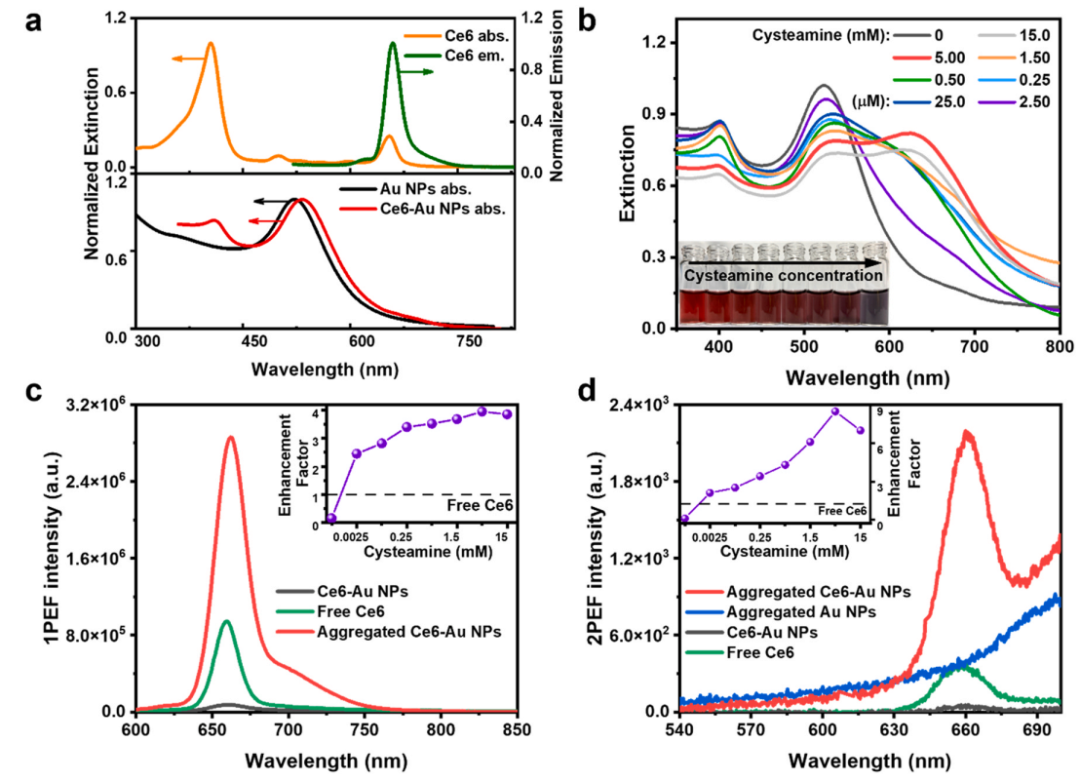
图2. 材料表征
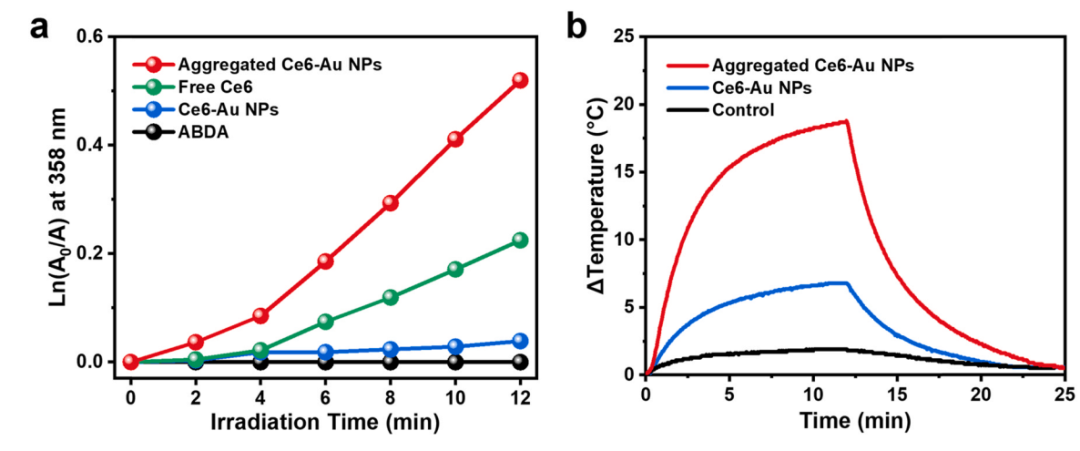
图3. (a)在游离的 Ce6,分离的和聚集的 Ce6-Au NPs 存在下,ABDA 的光氧化作为辐照时间的函数。(b) Ce6-Au 纳米粒子在连续激光照射下12分钟后关闭的水分散体的光热效应。
用游离 Ce6处理的癌细胞的共聚焦激光扫描显微镜图像的结果,在633nm激发下分离和聚集的 Ce6-Au NPs。在与Ce6-Au NPs孵育之前,通过与半胱胺预孵育在癌细胞内原位形成聚集的Ce6-Au NPs。用聚集的 Ce6-Au NPs 处理的细胞的荧光图像显示最好的对比度,比用游离Ce6处理的细胞的红色发射强得多,而用分离的 Ce6-Au NPs 处理的细胞的荧光图像显示最差的对比度。它们的荧光图像的相对亮度与它们在溶液中的相对荧光强度一致。在用半胱胺和 Ce6-Au NPs 处理的癌细胞的细胞质中观察到强烈的红色发射,表明这些纳米颗粒的有效细胞摄取和来自聚集的 Ce6-Au NPs 的荧光起源。这些结果也证实,尽管在溶液和细胞中的环境不同,Ce6-Au NPs确实在原位形成聚集体,并且在这些 HeLa 细胞中保持聚集体的形式。
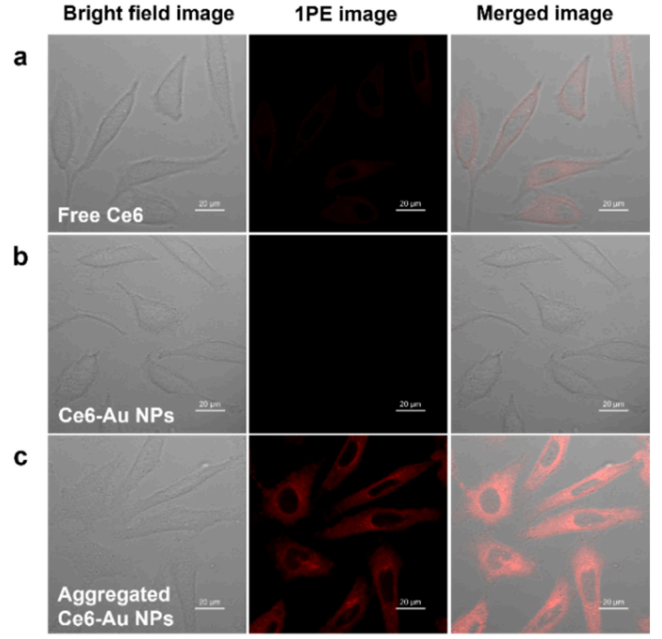
图4. 与游离 Ce6,分离和聚集的 Ce6-Au NPs 温育的 HeLa 癌细胞的明场图像(左) ,1PE 荧光图像(中)和合并图像(右)。