本期小编为大家分享一篇于2021年1月发表于Journal of Nuclear Medicine上的文章,题目为“PET Imaging of Tumor PD-L1 Expression with a Highly Specific Nonblocking Single-Domain Antibody”(DOI:10.2967/JNUMED.119.226712)。在这篇文章中,作者研发了一种靶向PD-L1的单域抗体探针——68Ga-NOTA-Nb109,用于探测体内PD-L1的表达水平,以辅助PD-1/PD-L1免疫治疗。本文通讯作者是江苏省原子医学研究所的吕高超教授。
研究背景
免疫检查点分子程序性死亡受体1(PD-1)具有重要的免疫抑制功能,当与其配体PD-L1结合后,通过传递抑制信号,从而阻止人体免疫系统对肿瘤的杀伤。因此,如果能阻断PD-1/PD-L1信号,就能够重新激活免疫系统。目前针对PD-1/PD-L1信号通路的治疗性抗体已在临床肿瘤患者的免疫治疗中取得了巨大成功。然而,并不是所有肿瘤患者都对该治疗有响应,研究表明其预后与PD-1/PD-L1的体内表达有关。因此精准检测PD-1/PD-L1的表达,可以用来筛选最有可能对PD-1/PD-L1免疫治疗作出反应的患者。
使用放射性核素标记的抗PD-L1抗体的PET成像可以从整体上直观且无创性地监测及评估肿瘤PD-1/PD-L1表达水平。然而完整的抗体由于分子量较大,在体内代谢较慢,需要较长时间才能获得清晰的显像结果。与完整抗体相比,单域抗体分子量小,具有良好的物理化学特性,在PD-L1靶向显像剂中具有巨大潜力。同时,抗体示踪剂应与PD-L1的治疗性抗体具有不同的结合位点,以不受治疗过程中的治疗性抗体影响。
设计思路
作者首先筛选制备出了一种与PD-L1具有高度亲和力的非阻断型单域抗体,即Nb109,再用螯合剂NOTA对其进行修饰,最后用核素68Ga进行标记,得到探针68Ga-NOTA-Nb109,并检测其产率及稳定性。随后选择PD-L1表达阳性的A375-hPD-L1细胞和PD-L1表达阴性的MCF-7细胞进行体外细胞摄取实验,制备荷瘤鼠模型,进行PET显像和生物分布研究,验证探针在体内外的靶向特异性,探索其在肿瘤免疫治疗中的应用价值。
数据分析
作者首先验证Nb109对PD-L1的高度亲和力和非阻断性的特点。用表面等离子共振检测Nb109对人PD-L1蛋白的亲和力,计算得到Nb109和PD-L1之间具有极低的解离平衡常数和高结合率常数(图1. A)。使用ELISA进行竞争性结合测定,在PD-1存在的情况下,Nb109和PD-L1的结合曲线之间呈经典的S型(图1. B),说明PD-1不影响Nb109和PD-L1的结合。
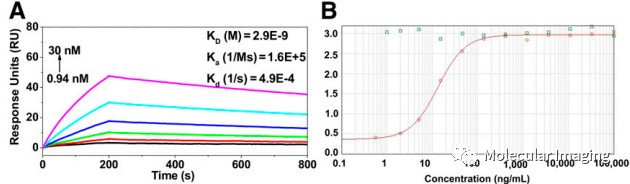
图1. A:表面等离子共振检测Nb109与PD-L1解离常数;B:Nb109与PD-L1的ELISA结合曲线。
设计成像探针,用螯合剂NOTA修饰Nb109后标记68Ga,经过Radio-HPLC检测,68Ga-NOTA-Nb109放射化学产率大于95%,放化纯度大于98%。该示踪剂的体外稳定性和免疫反应性良好(图2),保证了后续的体内成像研究。并且68Ga-NOTA-Nb109和Nb109与PD-L1的结合曲线的相似,这表明NOTA 与68GaCl3的螯合没有影响 Nb109对PD-L1的亲和力。
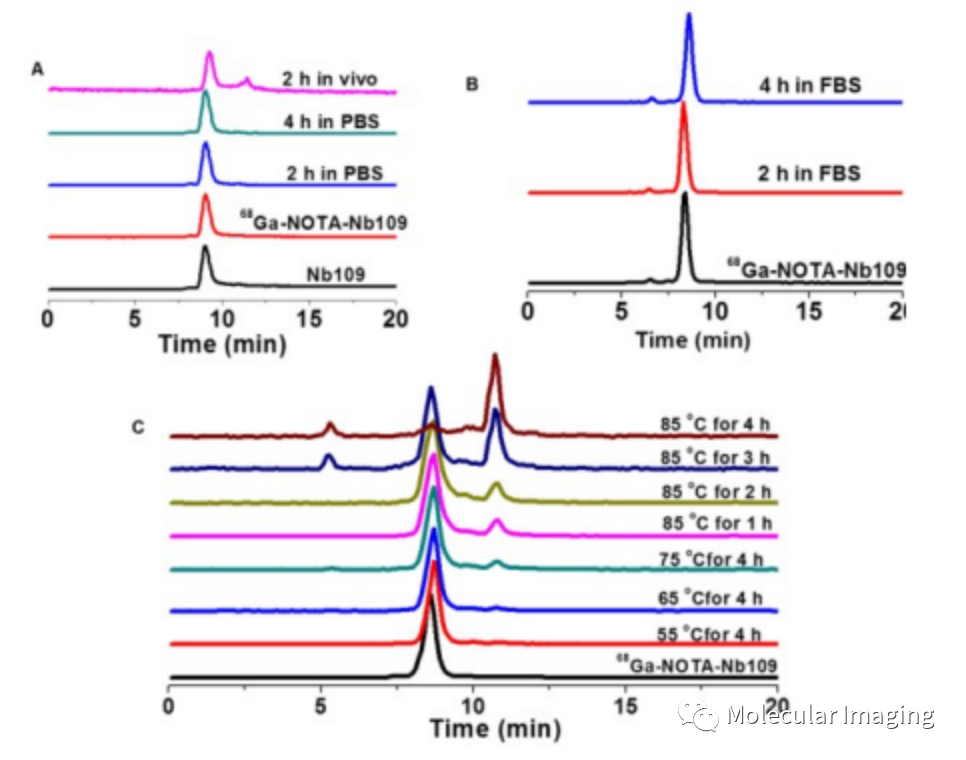
图2. 68Ga-NOTA-Nb109的高效液相色谱表征。
体外细胞实验中,A375-hPD-L1细胞对68Ga-NOTA-Nb109的摄取随孵育时间的增加而延长,2小时摄取率为6.3%±0.31%,显著高于阴性对照组MCF-7细胞的摄取率(1.3% ±0.44%) ,表明 68Ga-NOTA-Nb109 在肿瘤细胞中对 PD-L1 的特异性(图3)。为进一步验证Nb109的非阻断性,作者使用了目前获批作为治疗性抗体的KN035,提前30分钟将过量(1000倍)的KN035再加入放射性标记物进行孵育,检测结果与未处理组相当,表明Nb109与PD-L1的结合不受治疗性抗体影响(图4)。
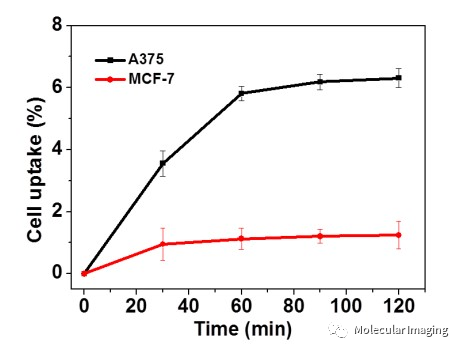
图3. 不同时间点A375-hPD-L1和 MCF-7细胞系中68Ga-NOTA-Nb109的细胞摄取。
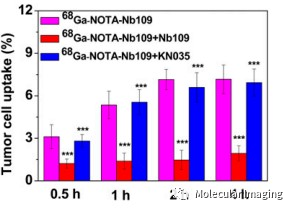
图4. 用未标记Nb109或KN035预处理与未预处理A375hPD-L1细胞系中68Ga-NOTA-Nb109摄取情况。
后续进行体内PET显像,作者将肿瘤细胞接种至裸鼠皮下,制成荷瘤鼠模型。经尾静脉注射68Ga-NOTA-Nb109后,进行2小时的动态影像记录。显像结果显示,荷瘤小鼠A375-hPD-L1细胞在注射10分钟后即出现高度的肿瘤摄取,该探针能准确地描绘病灶。而MCF-7细胞在任何时刻都不可见,用KN035预处理的小鼠在68Ga-NOTA-Nb109的摄取上与未预处理组相当(图5)。结果与体外细胞实验相印证。
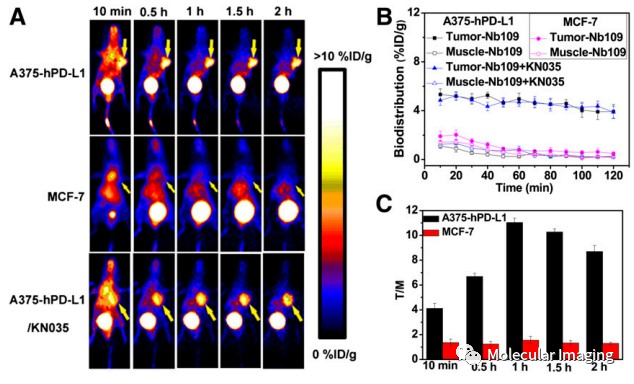
图5. 68Ga-NOTA-Nb109在PD-L1阳性(A375-Hpd-L1)及阴性(MCF-7)表达的肿瘤鼠体内PET显像。
为进一步展示68Ga-NOTA-Nb109对PD-L1的靶向能力,并排出个体差异影响,将A375-hPD-L1,A375-hPD-L1/A375(1/1, v/v),A375分别注入到同一只小鼠的不同肢体,并进行静态的PET显像。结果如预期,A375-hPD-L1肿瘤表现出最高的摄取,A375-hPD-L1/A375混合物在每个时间点的放射性摄取都为A375-hPD-L1的一半,而A375肿瘤未见明显摄取(图6. A, B)。这一结果与免疫组化显示的PD-L1表达情况密切吻合(图6. C)。
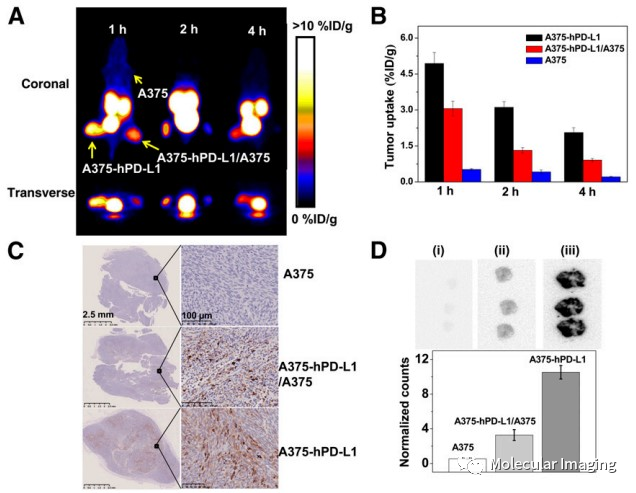
图6. 68Ga-NOTA-Nb109在A375-hPD-L1, A375-hPD-L1/A375(1/1, v/v), A375肿瘤鼠体内PET显像。
生物分布显示该探针有低骨骼和肌肉摄取和高肾脏摄取(图7),表明68Ga-NOTA-Nb109的组织非特异性摄取较低,本底干扰较低,具有良好的肿瘤靶向性。药代动力学显示探针能快速从血液中清除(图8),可减少正常组织不必要的辐射时间。
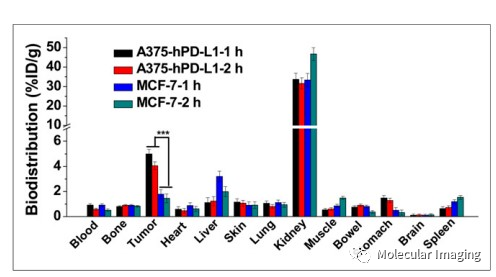
图7. 68Ga-NOTA-Nb109的生物分布分析。
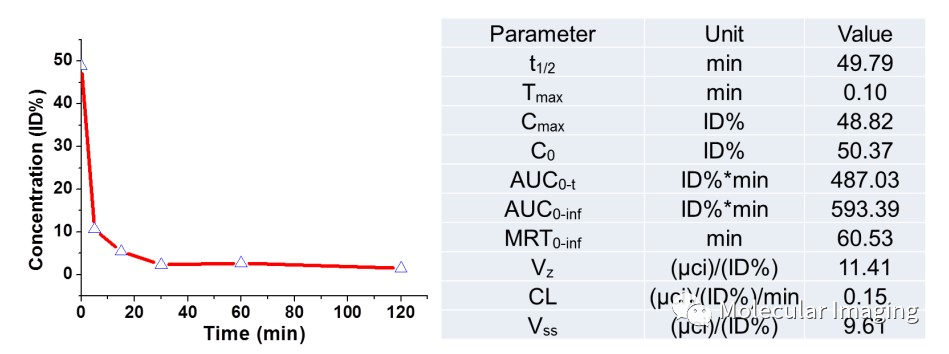
图8. 68Ga-NOTA-Nb109的药代动力学。
总结与展望
本文介绍了一种新的免疫PET探针,68Ga-NOTA-Nb109,用于体内PD-L1的PET成像,其能快速清晰显像,并能从血液中快速清除,具有高度的肿瘤/背景比,在肿瘤的PD1/PD-L1检查点阻断治疗方面有巨大的潜力。作者正在进一步探索该探针对体内肿瘤PD-L1水平变化动态监测的可行性,以更好地指导优化肿瘤治疗方案。