本周小编为大家分享是2020年12月23日发表在Biomaterials上的一篇文章,题目为“A dual-modal PET/near infrared fluorescent nanotag for long-term immune cell tracking”。文中,作者开发了一种基于正电子发射断层(PET)/近红外荧光(NIRF)纳米颗粒的双模态显像剂,并将其用于对人类CAR-T细胞进行非基因组标记。本研究利用该方法在SKOV3: hCEA(+)模型中实现了对CAR-T细胞的PET/NIRF双模态全身长期示踪,该示踪剂亦具备适用于其他癌症模型的潜力。Stefan Harmsen、 Emin Ilker Medine和Maxim Moroz为本文的共同第一作者,本文的通讯作者是纪念斯隆-凯特林癌症中心(MSKCC)的Omer Aras教授。

背景介绍
嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)免疫治疗可以精准靶向癌细胞,在B细胞系血液肿瘤的临床治疗上表现出良好的效果,但在实体瘤中由于肿瘤微环境等因素导致CAR-T疗法应用受限。为了更好地探究CAR-T细胞疗法和过继细胞转移疗法在实体瘤治疗中的局限性,进行T细胞过继后全身、实时的示踪是可行的解决策略之一。
通常,在临床前实验中使用基因组标记的方法,报告基因/蛋白质被引入细胞中,可用于检测或示踪被标记的细胞。在临床环境中,基因组标记的方法应用有限。结合前期的研究,作者开发了一种非基因组标记技术,使用PET/NIRF纳米颗粒标记细胞,同时实现高灵敏度的NIRF成像和PET成像,在荷瘤小鼠中监测CAR-T细胞移植后的分布。
设计思路
用两步法合成NIRF二氧化硅纳米颗粒,并使用89Zr(t1/2=78.4 h)核素对其进行标记,得到双模态PET/NIRF纳米标签。在鱼精蛋白和肝素包被下,使用PET/NIRF纳米标签标记CAR-T细胞(hCEA-CAR-T)。在体外检测相关颗粒和CAR-T细胞的生化特性后,经静脉或腹腔途径将标记后的CAR-T细胞注射到动物体内,进行PET和NIRF成像以监测CAR-T细胞的体内分布。
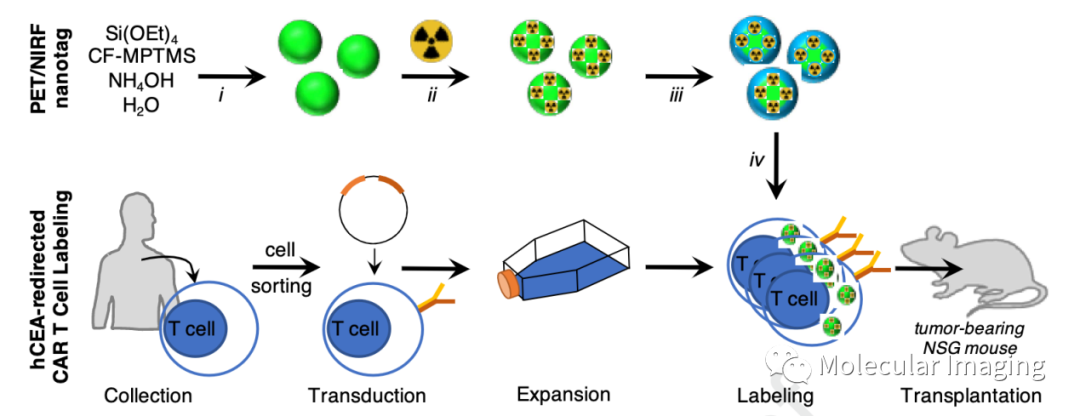
图1、实验设计方案。
数据分析
合成的NIRF纳米颗粒在Odyssey成像系统上测量的平均流体动力学直径为120 nm(图2. a)。经放射性核素89Zr标记后,iTLC结果显示所有89Zr都与NIRF纳米颗粒螯合,未检测到游离的89Zr(图2. c)。PET/NIRF纳米标签并未显著影响CAR-T细胞的细胞活力(图2. d)。但是,在CAR-T细胞被标记后的第7 d,上清液中的近红外荧光强度相较于第1、2 d明显增强,这可能是由于细胞凋亡导致了PET/NIRF纳米标签的释放(图2. e-f)。
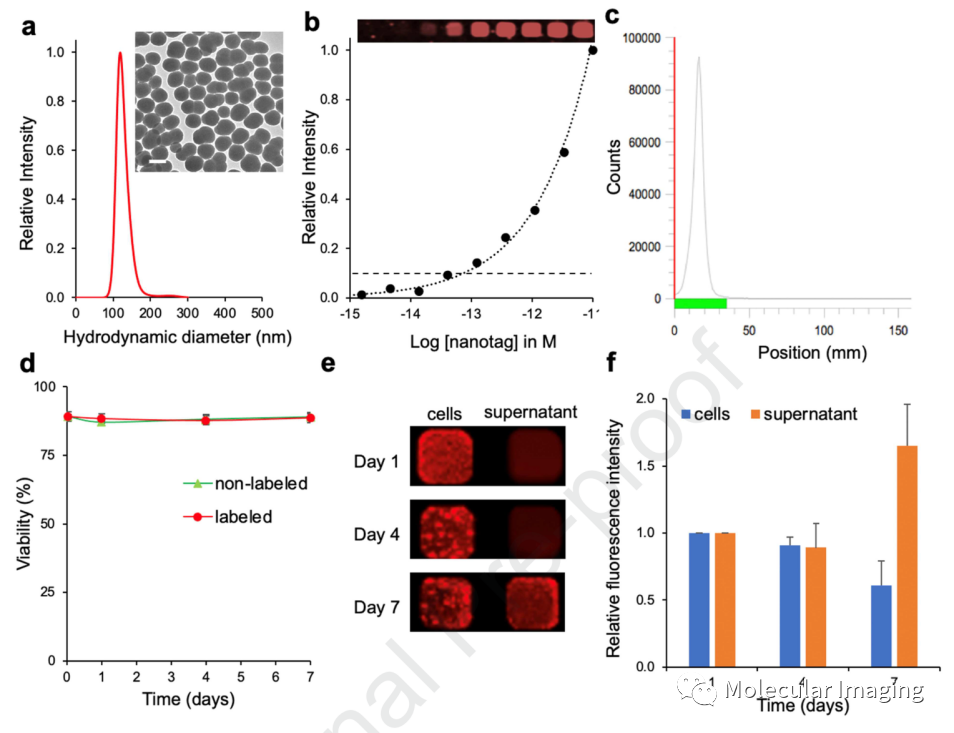
图2、PET/NIRF纳米标签的合成。
如图3所示,在鱼精蛋白和肝素存在下,PET/NIRF纳米标签对CAR-T细胞的标记率明显提高,且7 d后仍在CAR-T细胞上有保留。肝素是一种抗凝血剂,鱼精蛋白可逆转肝素的抗凝血作用。有研究证明,当肝素与鱼精蛋白混合后,二者通过静电作用快速形成纳米复合物,可促进细胞内药物递送。当标记后的CAR-T细胞与SKOV3: hCEA(+)细胞共培养时,其功能活性保留,能在体外诱导SKOV3细胞凋亡。
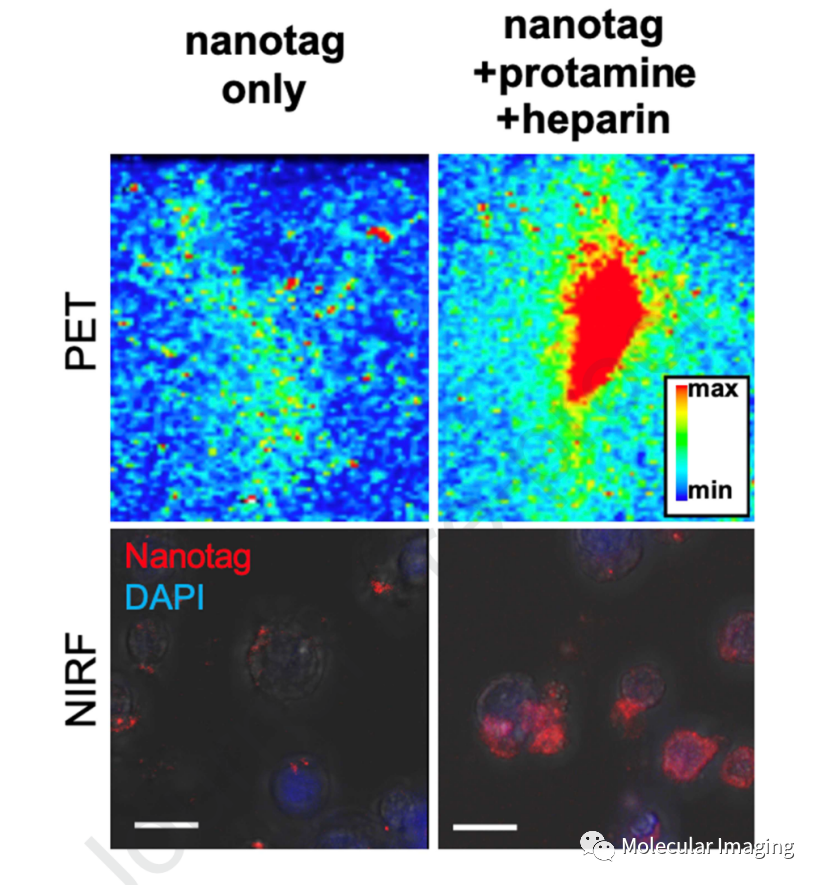
图3、PET/NIRF纳米标签对CAR-T细胞的标记。
接下来,作者以不同的给药途径探究使用带有PET/NIRF纳米标签的CAR-T细胞在动物体内进行长期细胞示踪和生物分布研究的可行性。将标记后的CAR-T细胞通过静脉或腹腔给药途径过继转移至未植瘤的野生型NSG小鼠体内。PET成像显示,静脉注射途径的CAR-T细胞主要分布在肺和肝脏,而腹腔注射途径的CAR-T细胞主要分布于肝脏和脾脏(图4. a)。值得注意的是,两种给药途径都会在骨骼中产生背景信号。免疫组化结果显示骨髓中存在人类CD3+T细胞(图4. c)。虽然游离的Zr4+离子具有高度的亲骨性,但前期的研究表明二氧化硅纳米颗粒以高亲和力结合Zr4+,并且也无证据证明静脉注射89Zr标记的二氧化硅纳米颗粒后,游离的89Zr4+会导致任何骨吸收。14 d后处死动物,相关器官的NIRF成像与PET成像之间具有良好的相关性(图4. b)。

图4、带有PET/NIRF纳米标签的CAR-T细胞的生物分布。
通过移植SKOV3:hCEA(+)细胞,建立腹膜癌动物模型。有研究表明,腹膜内给药是过继转移CAR-T细胞的可行途径。在过继转移带有PET/NIRF纳米标签的CAR-T细胞后1 d,SKOV3:hCEA(+)细胞和CAR-T细胞的生物发光成像(BLI)信号重叠;过继转移后7 d,CAR-T细胞的BLI和PET图像显示出明显的重叠,但PET图像上只有一个热点,这与BLI结果不匹配;过继转移后14 d,CAR-T细胞的BLI信号主要定位于单个焦点,与PET图像重叠少于第7 d(图5. a, b)。如图5. c所示,CAR-T细胞与病变共定位,但大部分位于肿瘤周围。BLI和PET成像之间的差异可能表明,在CAR-T细胞给药后的2周,PET/NIRF纳米标签由CAR-T细胞释放并沉积在原部位。使用NIRF对PET/NIRF纳米标签进行显微成像进一步证实了这一点。在第14 d ,PET/NIRF纳米标签不再与CAR-T细胞相关,但其信号与SKOV3:hCEA(+)细胞共定位(图5. d)。该结果表明过继转移后2周,PET/NIRF纳米标签与CAR-T细胞分离,并被运输到肿瘤沉积物中,与肿瘤细胞共定位。
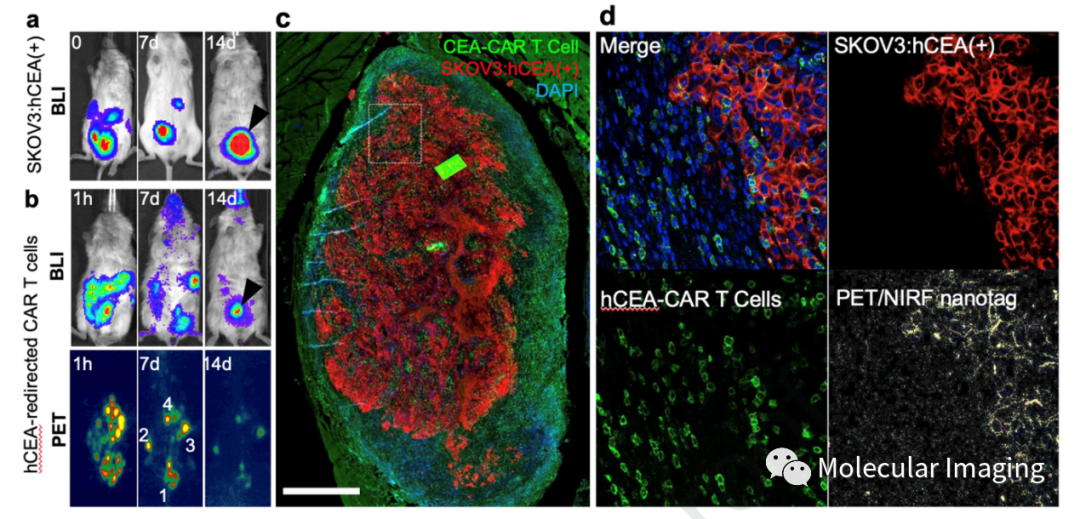
图5、CAR-T细胞在肿瘤部位的积聚。
总结与展望
在本研究中,作者证明了双模态PET/NIRF纳米颗粒显像剂应用的可行性,该显像剂能够结合全身PET以及高分辨率的近红外荧光成像技术,直接高效地进行非基因组细胞标记,可视化CAR-T细胞在过继转移后1 周的体内分布。由于细胞凋亡等原因,CAR-T细胞的PET/NIRF纳米标签在过继转移后2 周脱标,但释放的PET/NIRF纳米标签仍然保留在肿瘤细胞原位。本研究所使用的直接T细胞标记方法能够实现高纳米颗粒负载效率(> 80%),具有稳定的细胞内捕获和有效的肿瘤归巢能力,并能在肿瘤部位释放纳米颗粒。在未来的研究中,可进一步探讨将免疫细胞作为载体,使用本研究所用的直接细胞标记方法,改善纳米药物的肿瘤递送效率。