8月4日,中国科学技术大学生命科学与医学部教授周荣斌、江维团队和转化医学与创新药物国家重点实验室唐任宏团队合作,在《科学》(Science)上以First Release形式,在线发表了题为Pituitary hormone α-MSH promotes tumor-induced myelopoiesis and immunosuppression的研究论文(Research Article),报道了下丘脑-垂体轴及其产生的激素α-MSH在介导肿瘤诱导的髓系造血和免疫抑制中的关键作用。
肿瘤诱导的免疫抑制是其逃避免疫监视和攻击的重要原因。靶向PD-1和CTLA-4等靶点的免疫检查点治疗(ICT)策略在一定程度上能够逆转肿瘤免疫抑制并取得了较好的治疗效果,但临床响应性较低,需要进一步揭示肿瘤免疫抑制机制并寻找新的免疫治疗靶点和策略。
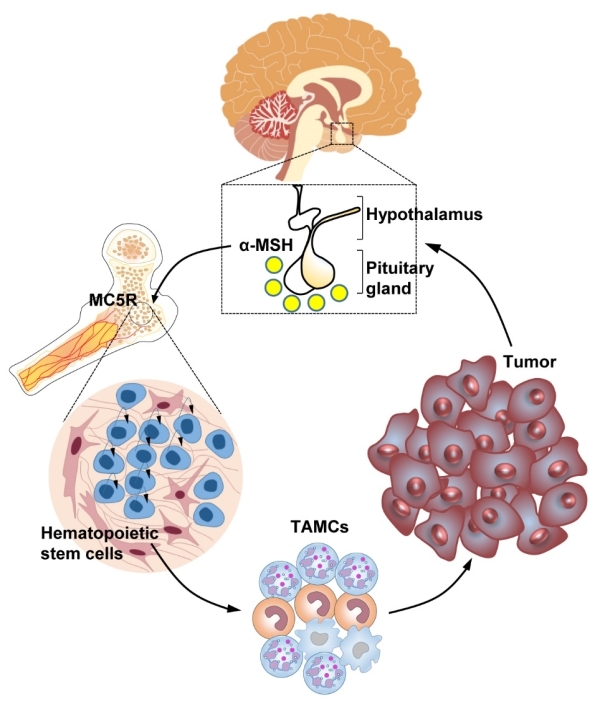
肿瘤患者常遭受抑郁、恐惧、焦虑等精神或情感应激,同时流行病学研究发现长期抑郁、压力会加速肿瘤的发展并削弱肿瘤免疫治疗的效果,表明神经系统及其介导的应激反应在肿瘤生长和免疫调控中发挥重要作用。下丘脑-垂体(HP)轴是神经内分泌系统的重要组成部分,也是机体感应应激反应的重要调节中枢。既往研究发现,HP可通过产生激素如促肾上腺皮质激素、促甲状腺激素和催乳素调节免疫反应。此外,在肿瘤患者中HP产生的雌激素、孕激素和糖皮质激素等一些下游激素或效应物显著升高,提示神经内分泌系统和HP轴可能调节肿瘤免疫,但HP轴在肿瘤免疫中的作用及免疫系统感应肿瘤诱导的神经应激的机制尚不清楚。
在该工作中,研究构建不同的肿瘤模型(ICT抵抗的LLC和B16F10-GMCSF肿瘤以及敏感的MC38和MCA205肿瘤)来探究下丘脑-垂体轴在肿瘤免疫中的作用,发现荷瘤小鼠血清中α-MSH浓度显著升高,但垂体产生的其他激素如内啡肽、促甲状腺激素、催乳素、卵泡刺激素、黄体生成素等无显著差异。同时,研究发现荷瘤小鼠下丘脑室旁核(PVH)神经元被激活,且垂体中叶负责编码α-MSH合成的蛋白POMC的表达也显著增强,表明肿瘤可促进下丘脑活化和垂体α-MSH产生。
为了进一步探索POMC及其产物α-MSH在肿瘤免疫中的作用,研究利用立体定位注射腺病毒载体的的方式敲低垂体Pomc基因的表达,而后进行荷瘤实验。结果显示敲低垂体Pomc的表达能够显著抑制不同皮下肿瘤的生长。同时,在B16F10肺转移模型和LLC原位肿瘤模型中,敲低垂体Pomc的表达也能够显著抑制肺部转移灶数目和肺部结节数量。进一步研究显示,敲低垂体Pomc表达能够增强抗肿瘤免疫能力,同时抑制髓系造血和肿瘤相关髓系细胞(MDSCs和TAMs等)的聚集。这表明垂体来源的α-MSH通过诱导髓系造血和免疫抑制促进肿瘤生长。
为了剖析α-MSH通过何种受体参与调控肿瘤诱导的髓系造血和免疫抑制,研究检测了α-MSH的受体的表达情况,发现MC5R在骨髓造血前体细胞高表达。研究构建Mc5r全身或条件型缺陷小鼠进行荷瘤实验,发现Mc5r缺陷可以显著地增强抗肿瘤免疫并抑制不同类型肿瘤的发生发展。此外,Mc5r缺陷可以抑制肿瘤诱导的髓系造血。更重要的是,不管是ICT敏感还是抵抗的肿瘤模型中,利用多肽抑制剂阻断MC5R均可抑制肿瘤生长,且MC5R多肽抑制剂与抗PD-1抗体联合使用可提高ICT的效率。
科研人员探讨了上述研究的临床相关性,发现非小细胞肺癌(NSCLC)和恶性头颈癌(HNC)患者血清中α-MSH浓度显著升高并与外周血中的MDSCs比例呈正相关。
该研究发现了肿瘤通过诱导下丘脑PVH神经元激活和垂体α-MSH产生促进肿瘤诱导的髓系造血和免疫抑制。研究的创新性体现在:发现一条介导肿瘤免疫抑制的神经内分泌通路——下丘脑-垂体-骨髓(HPB)轴;发现MC5R作为一个新的应激受体感应下丘脑-垂体信号促进髓系造血;发现MC5R可作为一个潜在的肿瘤免疫治疗新靶点。
研究工作得到国家自然科学基金、科技部、中科院和安徽省的支持。中国科大附属第一医院、安徽医科大学附属第一医院的科研人员参与研究。
中国科大等发现介导肿瘤免疫抑制的神经内分泌通路和免疫治疗新靶点