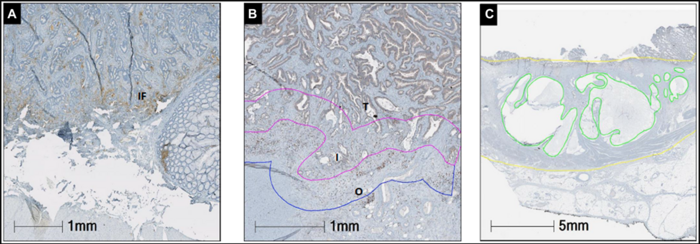
图1:PD-L1 (A)、CD8 (B)和粘蛋白(C)的代表性图像及染色。
一篇新的研究论文于2022年7月28日发表在《Oncotarget》杂志上,DNA损伤和由此产生的新抗原形成被认为是放射治疗和PD-1/PD-L1通路抑制协同作用诱导抗肿瘤免疫应答的机制。
在约翰霍普金斯大学医学院的Marina Baretti、Qingfeng Zhu、Wei Fu、Jeffrey Meyer、Hao Wang、Robert a . Anders和Nilofer S. Azad的一项新研究中,研究人员调查了新辅助放化疗(nCRT)诱导的直肠癌患者中CD8+肿瘤浸润淋巴细胞、PD-L1和黏液蛋白表达的变化。
CRT和PD-1/PD-L1免疫疗法的协同效应已在不同癌症类型的回顾性分析中得到支持,包括食管癌、膀胱癌和肺癌也支持[文][14,21,22]。然而,nCRT与免疫检查点抑制剂治疗协同作用以改善直肠癌肿瘤控制的作用仍不确定。”
本研究的目的是评估ncrt诱导直肠癌crt切除后TME[肿瘤微环境]的改变,特别关注PD-L1的表达和CD8+肿瘤浸润淋巴细胞(TILs)的密度。收集2008-2014年间接受nCRT治疗的(n = 62)和未接受nCRT治疗的(n = 17)直肠腺癌患者的肿瘤样本。
切片用CD8和PD-L1抗体进行免疫组化染色。记录肿瘤、界面瘤和直肠背景侧CD8+细胞的表达情况。图像分析测定CD8+淋巴细胞密度。人工计数PD-L1在肿瘤细胞(TC)、肿瘤间质(TS)和浸润前缘(IF)中的表达百分比。粘蛋白的表达量以粘蛋白面积占整个肿瘤面积的百分比来确定。
PD-L1在TCs上的表达在7.6%(6/79)的nCRT标本中被发现(p = 0.33),而在非nCRT患者中无PD-L1表达。CD8+浸润T淋巴细胞的中位密度在两组间无显著差异。nCRT后较高的中性粒细胞与淋巴细胞比值(NLR)与较差的预后相关(HR = 1.04, 95% CI = 1.00-1.08)。在nCRT队列中,Mucin表达明显高于对照组(p = 0.02)。
“这些发现表明了一种新的方式,通过放疗可以影响免疫TME,使其成为一种更具有免疫抑制表型。”
nCRT暴露与直肠腺癌患者PD-L1表达无显著差异相关,可能是由于样本量的限制。需要进一步的机制研究和全面的免疫分析来了解ncrt在直肠癌中诱导的免疫转移,并扩大检查点抑制剂在这种情况下的适用性。
“我们发现,与非nCRT病例相比,nCRT暴露与肿瘤细胞中更高的PD-L1表达相关。”
总之,该研究为nCRT在直肠癌中的免疫影响提供了进一步的数据。研究人员通过比较非crt病例的数据,评估了nCRT对CD8+TILsPDL-1表达的空间定位和对粘蛋白表达的影响,以及它们在直肠癌患者中的临床意义。为了更好地评估直肠癌的免疫环境和扩大检查点抑制剂在这种情况下的适用性,需要对术前和术后标本进行匹配的分析,并进行进一步的机制研究。
“因此,我们的研究结果表明,治疗后NLR可能具有预后作用,并可能有助于个性化辅助治疗,例如加强nCRT后NLR升高的患者的全身治疗。”